Professional Documents
Culture Documents
Volumen Molar Volumen
Uploaded by
Harry VirgoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Volumen Molar Volumen
Uploaded by
Harry VirgoCopyright:
Available Formats
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
VOLUMEN MOLAR PARCIAL
OBJETIVOS
C2 H 5 OH
Determinar el volumen parcial molar en una mezcla binaria de
agua a un determinado % peso.
Ve
Realizar una grfica de
(volumen especfico) de la solucin vs. % peso con
los datos experimentales.
Determinar la densidad de los lquidos empleando el picnmetro.
FUNDAMENTO TEORICO
Sea una solucin constituida por molculas A y B y en la cual los tamaos
moleculares y las atracciones intermoleculares de los pares A-A, B-B y A-B son
iguales; en estas condiciones se puede esperar un comportamiento lo ms simple
posible de la solucin, esta se considerara una solucin ideal ya que existe
uniformidad total de fuerzas intermoleculares que son consecuencia de un tamao
molecular y una estructura molecular semejante.
Analizando una propiedad de la solucin como volumen, para una solucin ideal:
Vm =VA + VB
Donde:
Vm: es el volumen de la mezcla
VA: Es el volumen del componente A puro
VB: es el volumen del componente B puro.
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
Al estudiar soluciones reales, se observa desviaciones del comportamiento ideal
debido a que se tiene componentes con tamaos moleculares diferentes entre
molculas del sistema no son iguales. Por ejemplo, al mezclar 50 ml de agua con 50
ml de metanol, el volumen de la solucin es de 95ml.
V m V A+ V B
Al estudiar este tipo de casos, no hay manera de determinar que parte de la
concentracin se debe al agua y que parte se debe al alcohol, dificultades semejantes
se observan en otras propiedades termodinmicas. Para resolver este problema y
emplear un mtodo para manejar composiciones variables, Lewis invent las
cantidades molares parciales, aplicables a cualquier propiedad termodinmica
extensiva como entalpa, energa interna, energa de Gibbs o el volumen.
DETERMINACIN DE MAGNITUDES MOLARES PARCIALES
Existen dos mtodos para determinar por va experimental cualquiera de las
Propiedades molares parciales:
i)
ii)
mtodo de la pendiente
mtodo de la interseccin de las ordenadas en el origen
Consideramos una disolucin de dos componentes, disolvente (1) y soluto
(2). El volumen total de la disolucin ser:
P,T Constante
i) Mtodo de la pendiente. Para medir el volumen molar parcial del
Componente 2, se preparan disoluciones con el mismo nmero de moles del
disolvente (1) (n1= cte) pero variando el nmero de moles del componente (2),
trabajando a presin y temperatura constantes (esto es fcil, vale con hacerlo a
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
temperatura ambiente en el laboratorio). Se mide el volumen total de las diferentes
disoluciones y se hace la siguiente tabla de los resultados experimentales.
Una vez obtenidos los volmenes totales se representa V de la disolucin
frente al nmero de moles del componente 2 de la siguiente forma:
Fig.
1.
Volmenes totales medidos para una serie
de disoluciones dondelas mezclas tienen
el mismo nmero de moles de disolvente
pero diferente nmero de moles de soluto,
a p y T constantes.
Segn se deduce de la ecuacin [2], la pendiente de la recta tangente a la curva a
cualquier composicin ser el volumen molar parcial del componente 2,V2. Y una vez
obtenidoV2 ser fcil conocer el volumen molar parcial del disolvente, utilizando la
ecuacin:
Recuerda el significado de la pendiente de la tangente a una curva: si se
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
representa la variable del numerador de una derivada en el eje y, y la variable
el denominador de la derivada en el eje x, SIEMPRE, la pendiente de la
tangente en un punto ser la magnitud que defina esa derivada. Para este
caso ser:
ii) Mtodo de las ordenadas en el origen:
Se prepara una serie de disoluciones a diferentes fracciones molares de 1 (Xi) y 2
(X2), y se representan los volmenes molares medidos para estas disoluciones, (V =
V/n, siendo n = n1+ n2) frente a la fraccin molar de uno de los componentes, X2.
Fig. 2. Volmenes molares medidos
para una serie de disoluciones donde
las mezclas tienen diferente fraccin
molar.
MATERIALES:
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
PROCEDIMIENTO EXPERIMENTAL
Secar bien el picnmetro en el secador para poner a pesar correctamente (limpio y
seco)
m1
masa
picnometro
Llenar con agua destilada el picnmetro luego pesar
m2 masa picnometro+ H O
2
Calcular el volumen del picnmetro con la relacin a una temperatura dada, en este
caso
T H O=17 C
2
H O =
2
17 C
m2m1
volumen picnometro
Determinar la densidad del
C2 H 5 OH /agua
a una determinada concentracin por
ejemplo, .a 40% p/p primero debemos de pesar la solucin. Ser una
m3=masa picnometro+C H
2
OH 4 0
por lo tanto la
masaC H
2
OH 4 0
=m3
m1
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
4 0
Luego calculamos
Con la siguiente relacin
masaC H
porque tenemos
4 0 =
OH 4 0
volumen picnometro
masaC H OH
volum en picnometro
2
40
CALCULOS Y RESULTADOS
Calculando los volmenes molares para el alcohol etlico a 40%,50%,60% 70%,80%
y 90% en concentracin:
PARA 40%:
masa picnometro =36.2555 g
masa picnometro +H O =60.5184 g
2
masa picnometro+C H
2
H O =0.99886
2
17
H O =
2
17
OH
=59.0660 g
g
ml
masa picnometro+ H Omasa picnometro
volumen picnometro
2
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
0.998 86=
60.518436.2555
volumen picnometro
volumen picnometro=24.29059
4 0 =
masa picnometro+C H OH masa picnometro
volumen picnometro
4 0 =
59.06636.2555
=0.939067 g /ml
24.29059
1
=1.064884 ml/ g
4 0
PARA 50%
5 0 =
masa picnom etro+ C H OH masa picnometro
volumen picnometro
5 0 =
58.60836.2555
=0.920212 g /ml
24.29059
1
=1.086706
5 0
PARA 60%
6 0 =
masapicnometro +C H OH masa picnometro
volumen picnometro
6 0 =
58.409536.2555
=0.91204 g/ml
24.29059
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
1
=1.096443 ml/ g
6 0
PARA 70%
7 0 =
masapicnometro +C H OH masa picnometro
volumen picnometro
7 0 =
58.595436.2555
=0.9 19693 g/ml
24.29059
1
=1.0 87319
7 0
PARA 80%
8 0 =
masapicnometro +C H OH masa picnometro
volumen picnometro
8 0 =
58.284936.2555
=0. 90691 g /ml
24.29059
1
=1.102645 ml /g
8 0
PARA 90%
9 0 =
masapicnometro +C H OH masa picnometro
volumen picnometro
9 0 =
57.925436.2555
=0.89211 g /ml
24.29059
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
1
=1.120938 ml/ g
9 0
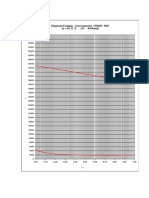
Graficando en data studio:
Con los resultados obtenidos debemos de realizar una grafica:
concentracin % p/p vs volumen especifico de solucin)
Ingresando datos: X (concentracin) y Y (volumen especifico de la solucin)
Ahora
debemos
calcular
los
volmenes especfico del agua y del alcohol. El valor del volumen especifico del agua
es la interseccin de la recta tangente con el eje y y la interseccin con x= 1 es el
volumen especifico del alcohol etlico.
Con los datos del volumen especfico hallamos la ecuacin:
Y = 8.4125x10-3 X2 + 0.080196 X + 1.0372288
La derivada de esta funcin ser la ecuacin de la recta tangente.
Y = 0.016825 X + 0.080196
Hallamos los volmenes parciales:
Para 0%
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
Y = 0.016825 (0) + 0.080196 = 0.080196 ml / g etanol
Solo habr,
Vagua = (0.080196 mL agua/ g agua ) x (18 g agua / 1 mol agua) = 1.443528 ml /mol
agua
Para 40%
Y = 0.016825 (0.4) + 0.080196 = 0.086926 ml / g mezcla
(0.086926 ml / g mezcla ) x (1g mezcla / 0.4 g etanol) x46 =9.99649 ml/mol etanol
(0.086926 ml / g mezcla ) x (1g mezcla / 0.6 g agua)x18 =2.60778 ml / g agua
Para 50%
(0.088608 ml / g mezcla ) x (1g mezcla / 0.5 g etanol)x46 =8.151936 ml / mol etanol
(0.088608 ml / g mezcla ) x (1g mezcla / 0.5 g etanol)x18 =3.189888 ml / mol agua
Para 60%
(0.090291 ml / g mezcla ) x (1g mezcla / 0.6 g etanol)x46 =6.92231 ml / mol etanol
(0.086926 ml / g mezcla ) x (1g mezcla / 0.4 g etanol)x18 =4.063095 ml / mol agua
Para 70%
(0.091973 ml / g mezcla ) x (1g mezcla / 0.7 g etanol)x46 =6.04394 ml / mol etanol
(0.091973 ml / g mezcla ) x (1g mezcla / 0.3 g etanol)x18 =5.51838 ml / mol agua
Para 80%
(0.093656 ml / g mezcla ) x (1g mezcla / 0.8 g etanol)x46 =5.38522 ml / mol etanol
(0.093656 ml / g mezcla ) x (1g mezcla / 0.2 g etanol)x18 = 8.42904 ml / mol agua
Para 90%
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
(0.095338 ml / g mezcla ) x (1g mezcla / 0.9 g etanol)x46 =4.872831 ml / mol etanol
(0.095338 ml / g mezcla ) x (1g mezcla / 0.1 g etanolx18) =17.16084 ml / mol agua
Para 100%
Y = 0.016825 (1) + 0.080196 = 0.097021 ml / g mezcla
V100% = (0.097021 mL / g etanol) x (46 g etanol/ 1 mol etanol) = 4.462966 ml/mol
etanol.
RECOMENDACIONES
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
Revisar que la balanza este seca y limpia para no obtener errores en los clculos.
Tener cuidado al llenar el picnmetro. Este no tiene que rebalsar.
Se recomienda utilizar la estufa para asegurarnos que nuestros materiales estn
completamente secos.
Tambin debemos evitar el contacto innecesario con el picnmetro ya que
estamos impregnando de grasa al tocarlo con las manos.
Debemos secar la parte exterior del picnmetro antes de llevar a la balanza
electrnica.
CONCLUSIONES
Se determin la densidad del alcohol a diferentes porcentajes (densidad de la
solucin) empleando el picnmetro a temperatura ambiente, obtenindose
menos error. El volumen especfico de la solucin es la inversa de la densidad
de la solucin.
De la grfica mostrada se obtuvo una curva que nos ayuda a determinar el
volumen especfico del agua y el volumen especfico del etanol.
A partir del volumen especifico que es la inversa de la densidad, se calcula el
volumen molar en L/MOL para hallar el volumen molar parcial, para el agua y el
etanol que conforman esta mezcla.
Notamos que la densidad disminuye al aumentar el porcentaje en peso, lo
cual hace que el volumen parcial del etanol aumente al aumentar el porcentaje
en peso de este.
Vemos que el volumen molar parcial de cada componente generalmente
cambia cuando se mezclan los componentes a diferentes proporciones, es
decir, el volumen molar parcial del alcohol de composicin 20% en peso, ser
diferente del volumen molar parcial del alcohol de composicin 90% en peso.
Lo mismo ocurre para el agua.
En la grfica es fcil ver que efectivamente el valor del volumen molar
parcial
de cada componente vara con la composicin.
BIBLIOGRAFIA
Fisicoqumica,
W. Atkins
IBEROAMERICANA; 1991
Editorial
ADDISON-WESLEY
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
Fisicoqumica 2
Fisicoqumica
Vol.
I,
Ira
Levine
Editorial
McGRAW-
HILL/INTERAMERICANA DE ESPAA ; 2004
Curso experimental de Fisico-Qumica,
MADRID, 1980
R. Portillo
Editorial
You might also like
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadFrom EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNo ratings yet
- Tarea 5 TQDocument15 pagesTarea 5 TQSayra Ivette Aranda AlcarazNo ratings yet
- Ejercicio de AletasDocument5 pagesEjercicio de Aletashernan666999No ratings yet
- Problema MetodosDocument5 pagesProblema MetodossaidNo ratings yet
- Ejercicios BEDocument6 pagesEjercicios BEAleyda Fernández LescanoNo ratings yet
- Termodinamica de SolucionesDocument30 pagesTermodinamica de SolucionesOliverTumbayNo ratings yet
- Procedimiento Basico para Un Negocio de TacosDocument5 pagesProcedimiento Basico para Un Negocio de TacosAarón LinaresNo ratings yet
- Antecedentes Del BásquetbolDocument8 pagesAntecedentes Del BásquetbolJuan Luis Sanches MuñosNo ratings yet
- Problemario Fenomenos de Transporte Tercer ParcialDocument4 pagesProblemario Fenomenos de Transporte Tercer ParcialKary Santomé100% (1)
- Taller1.Gases FisicoquimicaDocument6 pagesTaller1.Gases FisicoquimicaMiguel Angel SortizNo ratings yet
- Boyle Mendez TesisDocument108 pagesBoyle Mendez TesisYohana Lopez RosalesNo ratings yet
- Difusion en SólidosDocument28 pagesDifusion en SólidosIrma MartínezNo ratings yet
- Propiedades Molares ParcialesDocument18 pagesPropiedades Molares ParcialesFrancisco LaraNo ratings yet
- Operaciones unitarias II: Cálculo de caída de presión y velocidad de flujo en columna empacada con diferentes monturasDocument11 pagesOperaciones unitarias II: Cálculo de caída de presión y velocidad de flujo en columna empacada con diferentes monturasShamir Nuñez SolisNo ratings yet
- Problemas de termodinámica de gasesDocument2 pagesProblemas de termodinámica de gasesCarolinaZavaletaNo ratings yet
- David VeraDocument8 pagesDavid VeraBeatriz mendozaNo ratings yet
- Ejercicios de Balance de Materia Con RXNDocument3 pagesEjercicios de Balance de Materia Con RXNkomodiemoNo ratings yet
- Absorción de benceno en columna de platos a contracorrienteDocument7 pagesAbsorción de benceno en columna de platos a contracorrienteDann VCNo ratings yet
- Asignación AbsorciónDocument6 pagesAsignación AbsorciónWendy RiveraNo ratings yet
- Transferencia de Calor y Vapor SobresaturadoDocument4 pagesTransferencia de Calor y Vapor SobresaturadoYolimaNo ratings yet
- de Opraciones de Almibar de NaranjaDocument1 pagede Opraciones de Almibar de NaranjaReisner Esamat JintashNo ratings yet
- Práctica 7. - Difusividad Agua - Aire Por Convección ForzadaDocument10 pagesPráctica 7. - Difusividad Agua - Aire Por Convección ForzadaAZALEA LARA GARCIANo ratings yet
- Ecuacion de Naveir Stokes CilindricasDocument4 pagesEcuacion de Naveir Stokes CilindricasAn-ToNii Marka AndiaNo ratings yet
- Transferencia Taller 2Document9 pagesTransferencia Taller 2Angiie DilNo ratings yet
- Difusividad etanol-aguaDocument12 pagesDifusividad etanol-aguaPRISCILA ALEJANDRA CANO VILLEGASNo ratings yet
- Unifac TeoriaDocument6 pagesUnifac TeoriaWilver David Baquero GuerraNo ratings yet
- Problema 1.a-3.fenomenos de Transporte-BirdDocument7 pagesProblema 1.a-3.fenomenos de Transporte-BirdYesenia NuGaNo ratings yet
- Clase. Balance de MateriaDocument40 pagesClase. Balance de MateriaLluvia Linnett Martínez ReséndizNo ratings yet
- Problema de Transferencia de OxígenoDocument2 pagesProblema de Transferencia de OxígenoGianpierre Rojas AgapitoNo ratings yet
- Número de PrandtlDocument4 pagesNúmero de PrandtlJhon ManyaNo ratings yet
- Taller Unidad 2. Matemáticas para El Análisis de Sistemas de ControlDocument3 pagesTaller Unidad 2. Matemáticas para El Análisis de Sistemas de ControlIngrid Gómez GarzónNo ratings yet
- Taller de Resolución de Problemas 1-1Document2 pagesTaller de Resolución de Problemas 1-1david alcala100% (1)
- 45 49 55 PDFDocument7 pages45 49 55 PDFVictoriano Meza MaderaNo ratings yet
- Reporte de Minimos CuadradosDocument10 pagesReporte de Minimos CuadradosJulian Velez0% (1)
- Problemas Analisis Nodal-2018Document2 pagesProblemas Analisis Nodal-2018Juan Jose LlamoccaNo ratings yet
- Chichi PateDocument16 pagesChichi Patezoila eufemia choc coy0% (1)
- TallerDocument8 pagesTallerElianeth ZarateNo ratings yet
- Trabajo de Hidraulica 2 en PDF Redes HidraulicasDocument55 pagesTrabajo de Hidraulica 2 en PDF Redes HidraulicasYesbel LismaylinNo ratings yet
- Manual de Metodos Cuantitativos 2017Document44 pagesManual de Metodos Cuantitativos 2017ErikRodriguezNo ratings yet
- Informe Fenomenos de SuperficieDocument26 pagesInforme Fenomenos de SuperficieJosé0% (1)
- Métodos Opticos Espectroscopia de Absorcion AtomicaDocument59 pagesMétodos Opticos Espectroscopia de Absorcion AtomicaReymond MejíasNo ratings yet
- Coloquio Enzimas 1 RESUELTO-1Document3 pagesColoquio Enzimas 1 RESUELTO-1Luz CaballeroNo ratings yet
- Lab 2Document31 pagesLab 2Karen GallegosNo ratings yet
- PRACTICA Semanas 12,13y 14. Determinación Colorimétrica Del Hierro.Document3 pagesPRACTICA Semanas 12,13y 14. Determinación Colorimétrica Del Hierro.lizeth osorioNo ratings yet
- Ejecicio 11Document3 pagesEjecicio 11Liliana RuleNo ratings yet
- Optimización de áreas y volúmenesDocument134 pagesOptimización de áreas y volúmenesMariela Frias HernandezMZSNo ratings yet
- Solucion A ExamenDocument6 pagesSolucion A ExamenAngel Gutierrez FloresNo ratings yet
- Resumen Capitulo 2 Libro Termodinamica de CengelDocument5 pagesResumen Capitulo 2 Libro Termodinamica de CengelSophia CuadrosNo ratings yet
- EEDI U1 A2 Gier - DocxññññDocument7 pagesEEDI U1 A2 Gier - DocxññññGilberto EugenioNo ratings yet
- Guia Nro 2 Ind - 536 Inv 2021 Ecuación de La Conducción de CalorDocument8 pagesGuia Nro 2 Ind - 536 Inv 2021 Ecuación de La Conducción de CalorJose Fernando Ramos YampasiNo ratings yet
- Difusion Molecular en FluidosDocument51 pagesDifusion Molecular en FluidosRamón CevallosNo ratings yet
- Funcion de ForzamientoDocument4 pagesFuncion de ForzamientoSantiago RiveraNo ratings yet
- Ejercicios Conducción Calor UnidimensionalDocument4 pagesEjercicios Conducción Calor UnidimensionalDiego Alejandro Castaño BarragánNo ratings yet
- Imprii Calor ConodrDocument176 pagesImprii Calor ConodrvanessaNo ratings yet
- Reporte 4 Laboratorio de FisicoquimicaDocument17 pagesReporte 4 Laboratorio de FisicoquimicaCristian RangelOlvNo ratings yet
- Una Barra MetálicaDocument6 pagesUna Barra MetálicaRichard Chanini ChoquecotaNo ratings yet
- Capítulo 2 - Texto FTDocument41 pagesCapítulo 2 - Texto FTGióngManAymorickNo ratings yet
- Determinar La Longitud de La Tubería Necesaria para Alcanzar La Temperatura RequeridaDocument10 pagesDeterminar La Longitud de La Tubería Necesaria para Alcanzar La Temperatura RequeridarobertoNo ratings yet
- Volumen Molar ParcialDocument11 pagesVolumen Molar ParcialJose Luis IGNo ratings yet
- Clase 3a. Clase Magnitudes Molares ParcialesDocument39 pagesClase 3a. Clase Magnitudes Molares ParcialesJhon Ardila BariosNo ratings yet
- Procesos 2 - Ejercicio Clase 2Document6 pagesProcesos 2 - Ejercicio Clase 2Harry VirgoNo ratings yet
- Pregunta: PreguntaDocument1 pagePregunta: PreguntaHarry VirgoNo ratings yet
- Becas SIBAE2016Document2 pagesBecas SIBAE2016Harry VirgoNo ratings yet
- Problem de Transfer Masa IIDocument105 pagesProblem de Transfer Masa IIHarry VirgoNo ratings yet
- Decreto Supremo 326 2015 EfDocument2 pagesDecreto Supremo 326 2015 EfHarry VirgoNo ratings yet
- 2 CultoDocument1 page2 CultoHarry VirgoNo ratings yet
- Pregunta: PreguntaDocument1 pagePregunta: PreguntaHarry VirgoNo ratings yet
- Universidad Nacional Del Callao Oraa Facultad: Ingenieria Quimica Pagina: 1 Profesional de Ingenieria Quimica FECHA: 1/3/2017Document4 pagesUniversidad Nacional Del Callao Oraa Facultad: Ingenieria Quimica Pagina: 1 Profesional de Ingenieria Quimica FECHA: 1/3/2017Harry VirgoNo ratings yet
- Sistemas BifasicosDocument7 pagesSistemas BifasicosHarry VirgoNo ratings yet
- Procesos 2 - Ejercicio Clase 2Document6 pagesProcesos 2 - Ejercicio Clase 2Harry VirgoNo ratings yet
- Gestion de La Calidad TECSUP PDFDocument57 pagesGestion de La Calidad TECSUP PDFHarry VirgoNo ratings yet
- Ley Orgánica de EleccionesDocument82 pagesLey Orgánica de EleccionesChristian FigueroaNo ratings yet
- Diseño de SopladorDocument6 pagesDiseño de SopladorHarry VirgoNo ratings yet
- Clase 2 Contaminacion y Tratamiento de Las Emisiones AtmosfericasDocument73 pagesClase 2 Contaminacion y Tratamiento de Las Emisiones AtmosfericasHarry Virgo100% (1)
- TP 2Document2 pagesTP 2Harry VirgoNo ratings yet
- 09-Destilacion Metodo GraficoDocument39 pages09-Destilacion Metodo GraficoEdgar HernándezNo ratings yet
- TP 1Document6 pagesTP 1Harry VirgoNo ratings yet
- Clase Prc3a1ctica 2 2011Document57 pagesClase Prc3a1ctica 2 2011Henry ArenasNo ratings yet
- Caratula Fiq Unac 2Document1 pageCaratula Fiq Unac 2Harry VirgoNo ratings yet
- CL08 A00 Fenske V0Document3 pagesCL08 A00 Fenske V0EdiriosNo ratings yet
- Serial - InstruccionesDocument1 pageSerial - InstruccionesRaimer Cuello TovarNo ratings yet
- CLORO RESIDUAL, ES NECESARIO MANTENER PEQUEÑAS CONCENTRACIONES EN LA RED DE DISTRIBUCIÓNDocument12 pagesCLORO RESIDUAL, ES NECESARIO MANTENER PEQUEÑAS CONCENTRACIONES EN LA RED DE DISTRIBUCIÓNAndres Muro ManriqueNo ratings yet
- Jung Jung Jung Jung JungDocument3 pagesJung Jung Jung Jung JungHarry Virgo60% (5)
- Serial para Activar Los CodecsDocument1 pageSerial para Activar Los CodecsSosicoMaailmansaNo ratings yet
- CL08 A00 Fenske V0Document3 pagesCL08 A00 Fenske V0EdiriosNo ratings yet
- Leeme Leeme Leeme LeemeDocument1 pageLeeme Leeme Leeme LeemeHarry VirgoNo ratings yet
- Conceptual Violencia SexualDocument1 pageConceptual Violencia SexualHarry VirgoNo ratings yet
- Lagunasdeestabilizacindeaguasresidualesescuelacolombianadeingeniera 120509135915 Phpapp02Document7 pagesLagunasdeestabilizacindeaguasresidualesescuelacolombianadeingeniera 120509135915 Phpapp02Leonid Davila VieraNo ratings yet
- Tratamiento de Agua de Pozo para El Uso de Bebidas GaseosasDocument3 pagesTratamiento de Agua de Pozo para El Uso de Bebidas GaseosasHarry VirgoNo ratings yet
- Indice Langelier AguasDocument2 pagesIndice Langelier AguasHarry VirgoNo ratings yet
- Tema 7 Química Orgánica 1Document62 pagesTema 7 Química Orgánica 1facupujNo ratings yet
- Problemas de procesos de flujo y estado estable con compresores, intercambiadores de calor y turbinasDocument2 pagesProblemas de procesos de flujo y estado estable con compresores, intercambiadores de calor y turbinasRicardo GrajalesNo ratings yet
- Calculo de Cargas TérmicasDocument25 pagesCalculo de Cargas TérmicasrosangelNo ratings yet
- Taller Precalculo 2Document3 pagesTaller Precalculo 2Juan Sebastian Morales GiraldoNo ratings yet
- Wa0000.Document5 pagesWa0000.Romy AlexaNo ratings yet
- Oxoaniones y OxisalesDocument19 pagesOxoaniones y OxisalesElena LeivaNo ratings yet
- F2 - S04 - Wa - HT - Trasferencia de CalorDocument2 pagesF2 - S04 - Wa - HT - Trasferencia de CalorGianfranco MendozaNo ratings yet
- Unidad N °7 Uso Del RevaporizadoDocument7 pagesUnidad N °7 Uso Del Revaporizadobluesenmi100% (1)
- Índice de refracción de soluciones de etanolDocument16 pagesÍndice de refracción de soluciones de etanolFRANSNo ratings yet
- Teoria de La Doble Resistencia de WhitmanDocument16 pagesTeoria de La Doble Resistencia de WhitmanLupita CCNo ratings yet
- Taller 3 Cinética de EnzimasDocument1 pageTaller 3 Cinética de EnzimasValentina ArangoNo ratings yet
- Eme 3Document104 pagesEme 3Carla Ruiz SastreNo ratings yet
- LABORATORIO No. 06Document12 pagesLABORATORIO No. 06Juan Zamora AriasNo ratings yet
- Ingeniería Química - Taller de Fenómenos de TransporteDocument1 pageIngeniería Química - Taller de Fenómenos de TransporteMaría fernanda Sierra muskusNo ratings yet
- Instituto Tecnologico Superior de Las ChoapasDocument5 pagesInstituto Tecnologico Superior de Las Choapasalex contee cruzNo ratings yet
- Ejercicios Segunda Ley 2020-IIDocument2 pagesEjercicios Segunda Ley 2020-IIStefany Elizabeth Crisostomo QuispeNo ratings yet
- Poes-Medición de Cristal PrimitivoDocument8 pagesPoes-Medición de Cristal PrimitivoErickNo ratings yet
- Entropía: Problemas ResueltosDocument1 pageEntropía: Problemas ResueltosISAURA MARLENE LLAMAS GARCIANo ratings yet
- Test 1 Mec de FluidosDocument2 pagesTest 1 Mec de Fluidospilar melo100% (1)
- Reflexión, refracción y lentesDocument43 pagesReflexión, refracción y lentesDiana Lisbeth Poma EscobarNo ratings yet
- Sesión 2. TermoquimicaDocument29 pagesSesión 2. TermoquimicaLILI SOFIA JURADO PACHAMANGONo ratings yet
- Informe Termodinamica 1Document4 pagesInforme Termodinamica 1Lucho HCNo ratings yet
- Procesos de transferencia de calor y masaDocument16 pagesProcesos de transferencia de calor y masaAnonymous PPdYAK6580% (5)
- Previo 5 Disoluciones EyCDocument3 pagesPrevio 5 Disoluciones EyCUlises PerezNo ratings yet
- Dotación de Escaleras 2007Document218 pagesDotación de Escaleras 2007Arturo ChavesNo ratings yet
- PREINFORME. Grupo8.Oxidacion Del Ion Yoduro Con PersulfatoDocument8 pagesPREINFORME. Grupo8.Oxidacion Del Ion Yoduro Con PersulfatoBrissiNo ratings yet
- Porosidad lechos empacadosDocument25 pagesPorosidad lechos empacadosOscar Daniel MoralesNo ratings yet
- Informe Quimica1Document3 pagesInforme Quimica1Zharith GutierrezNo ratings yet
- Práctica 2. Fluidos No Newtonianos y Difusión de VaporDocument10 pagesPráctica 2. Fluidos No Newtonianos y Difusión de VaporMonica ZuletaNo ratings yet