Professional Documents
Culture Documents
Labo 4
Uploaded by
Kevin FloresOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Labo 4
Uploaded by
Kevin FloresCopyright:
Available Formats
INFORME N4: CONDUCTANCIA DE LOS ELECTROLITOS
1. OBJETIVOS
Determinar la conductividad especifica de los electrolitos fuertes y dbiles a diversas concentraciones. Determinar la conductividad especifica a disolucin especfica a disolucin infinita de los diversos electrolitos.
2. FUNDAMENTO TEORICO
Aunque la magnitud que se mide experimentalmente es la conductividad especfica (), no es esta una magnitud adecuada para el estudio del fenmeno de la conductividad de las disoluciones de los electrolitos. Por ejemplo, disoluciones de diferentes concentraciones tendrn siempre distinta conductividad especfica, ya que cada cm3 de las diferentes disoluciones contienen distinta cantidad de iones, y eso les hace tener distinta conductividad, y dado que lo que nos interesa comparar es la capacidad para producir corriente elctrica de un determinado nmero de cargas de un electrolito, a concentraciones diferentes, es de gran utilidad definir una nueva conductividad, que es la conductividad equivalente (), que es la conductividad por equivalente de soluto. La conductividad equivalente () fue definida por Kohlrausch como: =
1000. 1000 = N N
(1cm2equ1) Conductividad equivalente Donde C es la concentracin en equivalentes por cm3 N=
equivalentes soluto disolucin
De acuerdo con todo esto, la conductividad equivalente () es la conductividad que tiene una disolucin que contiene un equivalente gramo de soluto encerrado entre dos electrodos planos y paralelos separados 1 cm. = Conductividad especfica = Conductividad equivalente
La conductividad equivalente () no es una caracterstica de cada electrolito, sino que es un valor que va variando con la concentracin, hacindose mxima a dilucin infinita. Kohlrausch estudi la variacin de la conductividad equivalente de numerosos electrolitos a una temperatura determinada en funcin de la raz cuadrada de la concentracin y a una temperatura de 25C. Represent:
En caso de electrolitos fuertes, encontr que para estos electrolitos a concentraciones bajas, la conductividad equivalente se podra expresar por la ecuacin: = o-A C Donde A es una constante. En el caso de electrolitos dbiles es imposible hacer extrapolacin con seguridad debido al gran aumento de a altas diluciones, donde por otra parte, las medidas experimentales son menos precisas.
Variacin de la conductividad equivalente de electrolitos fuertes y dbiles con
Obtuvo unos resultados que le permitieron clasificar los electrolitos en dos tipos: 1. Electrolitos fuertes: aquellos que presentan prcticamente lineal, tal es el caso de KCl. una variacin
2. Electrolitos dbiles: los dems, como por ejemplo CH3COOH cido actico que tiene una disminucin brusca de la conductividad a concentraciones bajas. Segn la ley de la migracin de Kohlrausch, para electrolitos fuertes, la conductividad equivalente a dilucin infinita(o) de un electrolito, puede considerarse como resultado de las contribuciones de las dos clases de iones individuales que forma el electrolito. o =o(+) + o() Siendo o(+) y o() las conductividades inicas equivalentes a dilucin infinita del catin y el anin respectivamente 3. DATOS 3.1. T = 23 C CONCENTRAC (equiv/L) 1.0000 0.1000 0.0500 0.0100 0.0050 0.0010 0.0005 0.0001 AGUA DATOS EXPERIMENTALES: k = CONDUCTANCIA ESPECIFICA (S/cm) HCl 42100.0 21700.0 4500.0 2250.0 462.0 232.0 46.3 2.13 3.2. CH3COOH 515.50 368.00 169.00 118.00 53.90 37.45 16.17 1.88 DATOS TEORICOS: KCl 13540.00 6640.00 1389.00 776.00 172.10 87.10 19.71 2.20 NaCH3COO 4390.0 2410.0 607.0 292.0 70.2 35.9 9.56 2.4 NaCl 32000.0 10440.0 5490.0 1132.0 670.0 132.0 54.0 2.1
SUSTANCIA HCl CH3COOH KCl NaCH3COO NaCl
A DISOLUCION INFINITA (S.cm2/equiv) 426.1 390.6 149.9 91.0 126.5
4. CALCULOS Y GRAFICOS 1. Calcular la conductancia especifica para cada solucin acuosa de HCl, CH3COOH, KCl, NaCH3COO y NaCl. Para calcular la conductancia especifica de cada solucin es necesario restar la conductancia medida con el conductimetro de cada solucin menos la conductancia del agua. k = CONDUCTANCIA ESPECIFICA (S/cm) HCl 42097.87 21697.87 4497.87 2247.87 459.87 229.87 44.17 CH3COOH 513.62 366.12 167.12 116.12 52.02 35.57 14.29 KCl 13537.80 6637.80 1386.80 773.80 169.90 84.90 17.51 NaCH3COO 4387.6 2407.6 604.6 289.6 67.8 33.5 7.16 NaCl 31997.9 10437.9 5487.9 1129.9 667.9 129.9 51.9 -
T = 23 C CONCENTRAC (equiv/L) 1.0000 0.1000 0.0500 0.0100 0.0050 0.0010 0.0005 0.0001
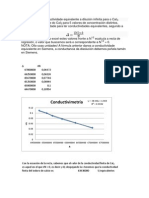
2. Representar en forma grafica la conductancia especifica respecto a la concentracin para el HCl, CH3COOH, KCl, NaCH3COO y NaCl.
HCl
CH3COOH
k vs. C (HCl)
42000 35000 k (s/cm) k (s/cm) 28000 21000 14000 7000 0 0.00 0.02 0.04 0.06 0.08 0.10 0.12 C (equiv/L) y = 422012x + 138.31 R = 0.9998 600 500 400 300 200 100 0
k vs. C (CH3COOH)
y = 4836.2x + 65.592 R = 0.9427
0.00 0.02 0.04 0.06 0.08 0.10 0.12 C (equiv/L)
KCl
NaCH3COO
k vs. C (KCl)
13800 11500 k (s/cm) k (s/cm) 9200 6900 4600 2300 0 0.00 0.02 0.04 0.06 0.08 0.10 0.12 C (equiv/L) y = 134570x + 27.011 R = 0.9999
k vs. C (NaCH3COO)
4200 3500 2800 2100 1400 700 0 0.00 0.02 0.04 0.06 0.08 0.10 0.12 C (equiv/L) y = 44004x + 66.675 R = 0.9973
NaCl
k vs. C (NaCl)
30000 25000
k (s/cm)
20000 15000 10000 5000 0 0.00 0.20 0.40 0.60 0.80 1.00 C (equiv/L) y = 30572x + 2034.5 R = 0.9454
3. Calcular la conductividad equivalente par cada solucin acuosa de HCl, CH3COOH, KCl, NaCH3COO y NaCl. Para este calculo es necesario emplear la siguiente ecuacin: = Donde:
1000.k C
k = Conductancia especifica de la solucin (S/cm) C = Concentracin de la solucin (equiv/L) = Conductividad equivalente de la solucin (S.cm2/equiv)
C=1N = C = 0.1 N = C = 0.05 N
k =31997.9 S/cm = 32.00 S.cm2/equiv k = 10437.9 S/cm = 104.38 S.cm2/equiv k = 5487.9 S/cm
= C = 0.01 N = C = 0.005 N = C = 0.001 N = C = 0.0005 N = -
= 109.76 S.cm2/equiv k = 1129.9 S/cm = 112.99 S.cm2/equiv k = 667.9 S/cm = 133.58 S.cm2/equiv k = 129.9 S/cm = 129.90 S.cm2/equiv k = 51.9 S/cm = 103.80 S.cm2/equiv
Los clculos para las dems soluciones se muestran en la siguiente tabla:
T = 23 C CONCENTRAC (equiv/L) 1.0000 0.1000 0.0500 0.0100 0.0050 0.0010 0.0005 0.0001
= CONDUCTIVIDAD EQUIVALENTE (S.cm2/equiv) HCl 420.98 433.96 449.79 449.57 459.87 459.74 441.70 CH3COOH 5.14 7.32 16.71 23.22 52.02 71.14 142.90 KCl 135.38 132.76 138.68 154.76 169.90 169.80 175.10 NaCH3COO 43.88 48.15 60.46 57.92 67.80 67.00 71.60 NaCl 32.00 104.38 109.76 112.99 133.58 129.90 103.80 -
4. Representar en forma grafica la conductividad equivalente respecto a la para el HCl, KCl, NaCH3COO y NaCl. Mediante la extrapolacin determinar el valor de para el HCl, KCl, NaCH3COO y NaCl cuando C = 0 (dilucin infinita). La grafica de en funcin de , es casi lineal para un electrolito fuerte, use el mtodo de mnimos cuadrados. Luego de realizar los clculos obtenemos los siguientes grficos con sus respectivas ecuaciones: HCl KCl
vs. C1/2 (HCl)
470 460 (S.cm2/equiv) (S.cm2/equiv) 450 440 430 420 0.00 0.08 C1/2 0.16 (equiv/L)1/2 0.24 0.32 y = -105.85x + 456.8 R = 0.7605 185 175 165 155 145 135 125 0.00
vs. C1/2 (KCl)
y = -134.37x + 168.63 R = 0.7374
0.08 C1/2
0.16 (equiv/L)1/2
0.24
0.32
NaCH3COO
- NaCl
vs. C1/2 (NaCH3COO)
77 70 (S.cm2/equiv) (S.cm2/equiv) 63 56 49 42 35 0.00 0.08 C1/2 0.16 0.24 0.32 (equiv/L)1/2 y = -86.24x + 69.086 R = 0.9288 138 120 102 84 66 48 30 0.00
vs. C1/2 (NaCl)
y = -91.987x + 126.96 R = 0.8923
0.20
0.40 C1/2
0.60
0.80
1.00
(equiv/L)1/2
Al realizar las graficas de cada una de las soluciones obtenemos por extrapolacin la conductancia equivalente a disolucin infinita, las cuales son las intersecciones de las rectas con el eje Y, estas son:
(HCl) = 456.80 S.cm2/equiv (KCl) = 168.63 S.cm2/equiv (NaCH3COO) = 69.09 S.cm2/equiv (NaCl) = 126.96 S.cm2/equiv
- Para hallar la conductancia equivalente a disolucin infinita del CH3COOH se toma la ecuacin de Kohlrausch y tenemos.
(CH3COOH) = (HCl) + (NaCH3COO) - (NaCl) (CH3COOH) = 456.80 + 69.09 126.96 (CH3COOH) = 398.93 S.cm2/equiv Con todos los datos encontrados experimentalmente y los datos tericos podemos hallar el % de error de cada solucin acuosa utilizando la siguiente ecuacin:
% ERROR =
* 100%
% ERROR (HCl) =
* 100 % = 7.20 %
% ERROR (KCl) =
* 100 % = 12.49 %
% ERROR (NaCH3COO) =
* 100 % = 24.08 %
% ERROR (NaCl) =
* 100 % = 0.36 %
% ERROR (CH3COOH) =
* 100 % = 2.13 %
5. DISCUSION DE RESULTADOS Los resultados obtenidos en el laboratorio estn muy cerca de los datos tericos ya que los errores obtenidos son mnimos y con esto podemos decir que el trabajo en laboratorio realizado por cada grupo ha sido correcto. Adems se puede observar que los datos obtenidos para calcular la conductancia equivalente del acido actico a disolucin infinita se adecuan a la ecuacin de Kohlrausch ya que al reemplazar los datos se corrobora esta ecuacin y el error es mnimo. Para un electrolito fuerte, se ve en la tendencia de la grafica a una recta (caso del HCl y dems sales) y para un electrolito dbil se tiene una tendencia a una curva asinttica (caso del acido actico). Para el agua destilada la fluctuacin de la conductancia es de 0.5 a 3 S/cm, y se nota que en todas las mediciones se tiene una conductividad entre 2 y 2.4 S/cm.
6. CONCLUSIONES Una de las principales conclusiones que se puede obtener de este laboratorio es que si se utilizan inadecuadamente los implementos de trabajo (agua destilada, lavado inadecuado de los tubos a utilizar, etc.) no se llegara a obtener datos satisfactorios. Las ecuaciones utilizadas en este laboratorio han sido adecuadas para realizar los clculos para la determinacin de las respectivas conductancias de las distintas muestras. Para los compuestos como el acido clorhdrico y el acido actico se puede destacar que a disolucin infinita tienen mayor conductancia que las sales utilizadas en el laboratorio ya que el protn ( H+=349.6 S*cm2/equiv.) presenta la ms alta conductancia que el reto de los dems cationes que se utiliza en el laboratorio ( Na+= 50.1) y otros aniones utilizados.
7. BIBLIOGRAFIA Remington, FARMACIA, SOLUCIONES INICA Y EQUILIBRIO INICO. Ed. Medica panamericana, 20va edicin, pg. 266 http://ocw.uv.es/ciencias/1-1/teo_conductividad_nuevo.pdf Revisado: 05/05/2013 http://ebookbrowse.com/op-sec-fisqui-supl-de-t-49-medidas-dela-conductividad-doc-d391885868 Revisado: 04/05/2013
You might also like
- CondutividadDocument15 pagesCondutividadjofre2324No ratings yet
- Conductancia de Los ElectrolitosDocument11 pagesConductancia de Los ElectrolitosCamisnzNo ratings yet
- Conductancia de Los ElectrolitosDocument13 pagesConductancia de Los ElectrolitosJohn MontellanosNo ratings yet
- Conductancia de Los ElectrolitosDocument9 pagesConductancia de Los ElectrolitosJazmin LeonNo ratings yet
- Conductancia de ElectrolitosDocument11 pagesConductancia de ElectrolitosKamila Quiroz LujánNo ratings yet
- CondutanciaDocument9 pagesCondutanciaOmar MuñozNo ratings yet
- Conductividad SolucionesDocument21 pagesConductividad SolucionesAlejandra MenecesNo ratings yet
- CalculosDocument12 pagesCalculosKevin RojasNo ratings yet
- Conductividad de Un ElectrolitoDocument12 pagesConductividad de Un ElectrolitoPiero Alejandro Estrada AngelesNo ratings yet
- Titulaciones ConductimetricasDocument11 pagesTitulaciones ConductimetricasJimmyFigueroaNo ratings yet
- Titulaciones conductimétricas para determinar concentraciones de HCl y AcOHDocument7 pagesTitulaciones conductimétricas para determinar concentraciones de HCl y AcOH1205lorenaNo ratings yet
- ConductimetriaDocument20 pagesConductimetriaJulioRaNo ratings yet
- Conductividad de Soluciones ElectroliticasDocument23 pagesConductividad de Soluciones ElectroliticasStephanyNo ratings yet
- Conductivímetria-Carlos CarballoDocument2 pagesConductivímetria-Carlos CarballoCarlos Carballo RodriguezNo ratings yet
- Reporte 2Document7 pagesReporte 2DENISSE PLATA ESPINOZANo ratings yet
- Conductividad de Soluciones Electroliticas - CompressDocument15 pagesConductividad de Soluciones Electroliticas - CompressFABRICIO TELMO MATIAS MALCA SANCHEZNo ratings yet
- Informe Lab ConductimetriaDocument10 pagesInforme Lab ConductimetriaAriel Pinto MarchantNo ratings yet
- P2 FpeDocument8 pagesP2 FpeDiegoNo ratings yet
- Informe 9 de Analisis CASI TerminadoDocument10 pagesInforme 9 de Analisis CASI TerminadoeduardoNo ratings yet
- Conductividad de electrolitosDocument11 pagesConductividad de electrolitosRenan LezamaNo ratings yet
- PRACTICA 2 CONDUCTIVIDAD DE SOLUCIONES ELECTROLITICAS-1 AdalidDocument9 pagesPRACTICA 2 CONDUCTIVIDAD DE SOLUCIONES ELECTROLITICAS-1 AdalidJoel ArismendiNo ratings yet
- Conductancia de ElectrolitosDocument10 pagesConductancia de ElectrolitosClaudiaNoeliaIngaGutierrezNo ratings yet
- Informe 13 - ConductividadDocument10 pagesInforme 13 - ConductividadKATHERINNE LUZ CHUCO DE LA CRUZNo ratings yet
- Conductividad ElectricaDocument7 pagesConductividad ElectricaMyle KrizkruNo ratings yet
- QM-2512 Tarea 1Document2 pagesQM-2512 Tarea 1Johan RojasNo ratings yet
- Coeficiente de Tranferencia Convectiva de Masa-140228Document11 pagesCoeficiente de Tranferencia Convectiva de Masa-140228Javier Rodriguez75% (4)
- G5.II-Conductividad y Cinética ElectroquímicaDocument3 pagesG5.II-Conductividad y Cinética Electroquímicamariasolruiz1984No ratings yet
- Conductividad MolarDocument6 pagesConductividad MolarConsiito OrdoñezNo ratings yet
- ConductimetríaDocument7 pagesConductimetríaAlvaro EtcheverryNo ratings yet
- 001 - Tarea de Problemas de Fisicoquímica IIDocument7 pages001 - Tarea de Problemas de Fisicoquímica IINataly FernándezNo ratings yet
- PC PDFDocument2 pagesPC PDFBrandonNo ratings yet
- Labo 13 Conductividad de Soluciones ElectroliticasDocument22 pagesLabo 13 Conductividad de Soluciones ElectroliticasWashington Quisperima GaldósNo ratings yet
- Conductividad ElectroliticaDocument18 pagesConductividad ElectroliticaJorge Luis CalleNo ratings yet
- Fenómenos de Transporte en Soluciones ElectrolíticasDocument5 pagesFenómenos de Transporte en Soluciones ElectrolíticasCristian DiazNo ratings yet
- Electroquimica InformeDocument9 pagesElectroquimica InformeGiselNo ratings yet
- Difusividad molecular en gases y líquidosDocument15 pagesDifusividad molecular en gases y líquidosBrenda Way Lee100% (1)
- Informe Instrumental 4Document12 pagesInforme Instrumental 4ediaz_956003No ratings yet
- Procedimiento Experimental, Tabulación de Datos y ResultadosDocument11 pagesProcedimiento Experimental, Tabulación de Datos y ResultadosJoselyn Matias BrañezNo ratings yet
- Conductividad de Soluciones ElectroliticasDocument25 pagesConductividad de Soluciones ElectroliticasJuan Pablo Moran CaballeroNo ratings yet
- Titulacion ConductimetricaDocument7 pagesTitulacion ConductimetricaGabs VencesNo ratings yet
- Lab. FisicoQuimica II 4Document14 pagesLab. FisicoQuimica II 4Lauren SmithNo ratings yet
- Informe de ConductimetriaDocument4 pagesInforme de ConductimetriaOsmar Villagra100% (1)
- Conductividad ElectricaDocument20 pagesConductividad ElectricaAnaZuñigaSolisNo ratings yet
- Microsoft Word - Repartido N 1 Transporte Ionico 2010Document4 pagesMicrosoft Word - Repartido N 1 Transporte Ionico 2010Santiago MedinaNo ratings yet
- TRANSPORTE DE CALOR EN SISTEMAS MULTIFASEDocument6 pagesTRANSPORTE DE CALOR EN SISTEMAS MULTIFASEluisNo ratings yet
- Fisicoquímica II - Conductividad de ElectrolitosDocument27 pagesFisicoquímica II - Conductividad de ElectrolitosYanethPacheco100% (1)
- ES - 2510 B. - ConductividadDocument8 pagesES - 2510 B. - ConductividadOperaciones L y LNo ratings yet
- Informe 3 ConcuctanciaDocument22 pagesInforme 3 ConcuctanciaMarco Dueñas FloresNo ratings yet
- Conductividad ElectricaDocument14 pagesConductividad Electricaluis romeroNo ratings yet
- ADSOPDocument6 pagesADSOPLaura Bustamante CalleNo ratings yet
- Cuestionario 17 Conductividad de Electrolitos PDFDocument1 pageCuestionario 17 Conductividad de Electrolitos PDFErik Ariel LauraNo ratings yet
- CONDUCTIMETRIADocument37 pagesCONDUCTIMETRIAdonatoNo ratings yet
- Problema Aplicacion Tema 2.2.3 Modelo de PotenciasDocument6 pagesProblema Aplicacion Tema 2.2.3 Modelo de PotenciasSergio Alejandro Medina MorenoNo ratings yet
- (654840425) Gasesreales - Problemasresueltos. 18017Document14 pages(654840425) Gasesreales - Problemasresueltos. 18017henryNo ratings yet
- Problemas de Cinética QuímicaDocument5 pagesProblemas de Cinética QuímicaCharlotte BaskervilleNo ratings yet
- Practica 2. FPEDocument8 pagesPractica 2. FPEZyanya HernándezMNo ratings yet
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Ingeniería química. Soluciones a los problemas del tomo IFrom EverandIngeniería química. Soluciones a los problemas del tomo INo ratings yet
- Informe 1Document9 pagesInforme 1Kevin FloresNo ratings yet
- Labo 1Document10 pagesLabo 1Kevin FloresNo ratings yet
- Informe 2Document9 pagesInforme 2Kevin FloresNo ratings yet
- Lab 8Document9 pagesLab 8Kevin FloresNo ratings yet
- Instrumentacion RefineriaDocument25 pagesInstrumentacion RefineriaKevin Flores100% (2)
- Informe 1Document9 pagesInforme 1Kevin FloresNo ratings yet
- Labo 2Document8 pagesLabo 2Kevin FloresNo ratings yet
- Minimizacion de Desperdicios IndustrialesDocument8 pagesMinimizacion de Desperdicios IndustrialesKevin FloresNo ratings yet
- Labo 1Document11 pagesLabo 1Kevin FloresNo ratings yet
- Labo 4Document6 pagesLabo 4Kevin FloresNo ratings yet
- Lab 2Document5 pagesLab 2Kevin FloresNo ratings yet
- Lab 1Document7 pagesLab 1Kevin FloresNo ratings yet
- Lab 2Document5 pagesLab 2Kevin FloresNo ratings yet
- Labo 1Document10 pagesLabo 1Kevin FloresNo ratings yet
- Labo 1Document11 pagesLabo 1Kevin FloresNo ratings yet
- Lab 1Document13 pagesLab 1Kevin FloresNo ratings yet
- Labo 4Document6 pagesLabo 4Kevin FloresNo ratings yet
- 24 Principios Basicos de Quimica Analitica CualtitativaDocument182 pages24 Principios Basicos de Quimica Analitica CualtitativaJhonernest Berrios Gallego100% (1)
- Minerales y ElectrolitosDocument19 pagesMinerales y ElectrolitosRICARDONo ratings yet
- EC Bebidas HidratantesDocument4 pagesEC Bebidas Hidratantessanthy parkerNo ratings yet
- Titulaciones Acido-BaseDocument49 pagesTitulaciones Acido-BaseYareli ChavezNo ratings yet
- Iacc Quimica Tarea3Document8 pagesIacc Quimica Tarea3Camila Aguero ArgelNo ratings yet
- Degradación electroquímica de colorantes en agua usando electrodos de hierroDocument74 pagesDegradación electroquímica de colorantes en agua usando electrodos de hierroPao CandoNo ratings yet
- CorrosiónDocument17 pagesCorrosiónDiego FernandoNo ratings yet
- Instrumentacion Basica de Procesos Industrtiales ISA - Parte3Document240 pagesInstrumentacion Basica de Procesos Industrtiales ISA - Parte3Gibbe1000No ratings yet
- Informe N 13 ConductividadDocument38 pagesInforme N 13 ConductividadFreddyPortocarreroNo ratings yet
- NormasDocument32 pagesNormasEddyson BaqueroNo ratings yet
- Ringer LactatoDocument6 pagesRinger Lactatop_romero_c100% (1)
- Celdas ElectrolíticasDocument4 pagesCeldas Electrolíticasjose100% (1)
- Enfermedades Diarreicas AgudasDocument12 pagesEnfermedades Diarreicas AgudasStuard DelcoNo ratings yet
- Construcción pilas y bateríasDocument6 pagesConstrucción pilas y bateríasMoises Hernandez50% (2)
- La electroremediación: una técnica efectiva para la remediación de suelos contaminadosDocument27 pagesLa electroremediación: una técnica efectiva para la remediación de suelos contaminadosJair Torres PaucarNo ratings yet
- Unidad II. Equilibrio Ionico. Quimica AnaliticaDocument28 pagesUnidad II. Equilibrio Ionico. Quimica AnaliticaCARLOS VICUÑANo ratings yet
- Polarización InducidaDocument16 pagesPolarización InducidaTom AndyNo ratings yet
- TITULACIONES-CONDUCTIMETRICAS PlanchaDocument12 pagesTITULACIONES-CONDUCTIMETRICAS PlanchaCristhian GilioNo ratings yet
- PRE S13V 2024-1 RevisadoDocument36 pagesPRE S13V 2024-1 Revisadocotrina4a.arNo ratings yet
- Cristalo I deDocument4 pagesCristalo I deJovanni Alexandre Macias MatusNo ratings yet
- Cartilla Circulares Técnicas Sep 25 - 2016 PDFDocument387 pagesCartilla Circulares Técnicas Sep 25 - 2016 PDFjavier ruiz80% (5)
- Agua y ElectrolitosDocument11 pagesAgua y ElectrolitosLaura E. Reyes CerónNo ratings yet
- Practica 5 ElectroDocument12 pagesPractica 5 Electrofannhy hzNo ratings yet
- Electro Quimica Potencial Del ElectrodoDocument29 pagesElectro Quimica Potencial Del ElectrodoAlfaro RodalyNo ratings yet
- Informe Propiedades de Los Compuestos Ionicos y Covalentes-Carolyn Camila Guerrero Martínez - AsdDocument5 pagesInforme Propiedades de Los Compuestos Ionicos y Covalentes-Carolyn Camila Guerrero Martínez - AsdCamila MartínezNo ratings yet
- 04 Área EWDocument84 pages04 Área EWFrancisco Eduardo Lopez SalazarNo ratings yet
- Administracion de Medicamentos2014Document73 pagesAdministracion de Medicamentos2014Alexis Galleguillos GuerraNo ratings yet
- Medicamentos FotosensiblesDocument13 pagesMedicamentos FotosensiblesYenysCeciliaNo ratings yet
- Baños GalvánicosDocument24 pagesBaños GalvánicosJaime Ramos67% (3)
- Electrólisis agua informe tallerDocument7 pagesElectrólisis agua informe tallerJoel JimenezNo ratings yet