Professional Documents
Culture Documents
2 Utilidaddeldopplerenobstetricia
Uploaded by
loremarrodOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
2 Utilidaddeldopplerenobstetricia
Uploaded by
loremarrodCopyright:
Available Formats
UTILIDAD DE LA FLUJOMETRIA DOPPLER EN
OBSTETRICIA
I. DESCRIPCIN GENERAL DE LOS VASOS SANGUNEOS EVALUADOS A
TRAVS DE LA FLUJOMETRA DOPPLER.............................................................................. 2
II. UTILIDAD DEL DOPPLER EN CUADROS SECUNDARIOS A INSUFICIENCIA
PLACENTARIA, PREECLAMPSIA Y RESTRICCIN DE CRECIMIENTO FETAL.. 16
III. UTILIDAD DEL DOPPLER EN EL DIAGNSTICO DE ANEMIA FETAL
ALOINMUNE........................................................................................................................................ 38
IV. UTILIDAD DEL DOPPLER EN EL EMBARAZO GEMELAR MONOCORIAL...... 44
V. DOPPLER Y ANEUPLOIDIA................................................................................................... 47
Dr. Mauro Parra C.
Profesor Asistente
Jefe Unidad Medicina Fetal
Hospital Clnico Universidad de Chile
2
I. DESCRIPCIN GENERAL DE LOS VASOS SANGUNEOS
EVALUADOS A TRAVS DE LA FLUJOMETRA DOPPLER
1. ARTERIA UTERINA
Anatoma de la arteria uterina
El flujo sanguneo del tero es aportado principalmente por la
arteria uterina, rama de la arteria ilaca interna, y en escasa cantidad
por las arterias ovricas. Estos vasos se anastomosan a nivel de los
cuernos del cuerpo uterino, lugar donde dan origen a las arterias
arcuatas y posteriormente stas generan a las arterias radiales. Estas
ltimas penetran en ngulo recto en el tercio externo del miometrio,
lugar desde donde surgen las arterias basales, nutriendo al miometrio y
la decidua, y finalmente alrededor de 100 arterias espiraladas que
terminan en el espacio intervelloso. Existen alrededor de 100 arterias
espiraladas.
Cambios fisiolgicos en el embarazo
Los cambios fisiolgicos de las arterias espiraladas son necesarios
para permitir el aumento del flujo teroplacentario de 10 veces durante
el curso del embarazo, desde 40 mL/min a 400 mL/min al trmino de la
gestacin. Estos cambios se caracterizan por tener un lumen dilatado y
tortuoso con ausencia completa de la capa muscular y elstica, el cual
es mediado por la invasin del trofoblasto extravellositario a partir de
las 12 semanas de gestacin. Esta transformacin de las arterias
espiraladas en arteria teroplacentarias comprende los segmentos
deciduales y miometriales. Como resultado de los cambios fisiolgicos
anteriormente sealados, el dimetro de las arterias espiraladas
aumenta desde 1520 a 300500 mm, lo cual reduce la impedancia al
flujo y optimiza el intercambio feto-placentario en el espacio
intervelloso.
Flujometra Doppler de las arterias uterinas:
Desde la primera descripcin de Campbell y cols,
de las arterias
arcuatas con Doppler pulsado, una serie de investigadores y avances
tecnolgicos han permitido obtener ondas de flujo sanguneo de mejor
calidad y precisin a travs del Doppler color. (Figura 1-3)
3
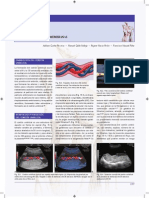
Figura 1. Imagen de Doppler color transabdominal en embarazo
con placentacin fisiolgica normal.
Figura 2. Imagen de Doppler de arterina transvaginal normal y
patolgica.
Figura 3. Doppler de arteria uterina con IP normal entre 11-14
semanas de gestacin.
4
La determinacin del Doppler color de las arterias uterinas por va
transabdominal se realiza a nivel del cruce aparente entre la arteria
uterina e ilaca externa.
1
Si la visualizacin se realiza por va
transvaginal, el punto de insonacin debe realizarse a nivel del orificio
interno del canal cervical, punto de entrada de la arteria uterina al
tero.
2
2
Si se realiza este mismo Doppler en el primer trimestre, 11-14
semanas de gestacin, el reconocimiento de este vaso se realiza a
travs de una seccin longitudinal del tero y empleando Doppler color
es posible determinar el vaso uterino a nivel del orificio cervical interno.
3
La impedancia al flujo sanguneo de las arterias uterinas disminuye
paulatinamente hasta las 24 semanas de gestacin debido al proceso de
transformacin fisiolgica de las arterias uterinas discutidas
anteriormente. Posteriormente, la disminucin de la resistencia del flujo
tero-placentario persiste debido al efecto de las hormonas
gestacionales (Figura 4).
Figura 4. Valores normales del IP proimedio de la arteria uterina
Indice de pulsatilidad promedio de
arteria uterina
0.00
0.50
1.00
1.50
2.00
2.50
3.00
3.50
12 16 20 24 28 32 36 40
Edad gestacional (sem)
2. ARTERIA UMBILICAL
5
El flujo del cordn umbilical se caracteriza por un flujo en
serrucho de la arteria umbilical en una direccin y el flujo continuo de
la vena umbilical en direccin opuesta, el cual es muy simple de obtener
a travs del Doppler continuo o pulsado, con o sin el empleo del
color.(Figura 5)
Figura 5. Doppler color de arteria umbilical demostrando un flujo
normal
Se recomienda realizar la medicin del Doppler de la arteria
umbilical en una porcin de asa libre lo ms equidistante a ambas zonas
terminales, fetal y placentaria, debido a que algunos autores sostienen
que los ndices de resistencia son menores a nivel de la insercin
placentaria. Los patrones de la arteria umbilical pueden variar durante
los ciclos de respiracin fetal, aumentado la resistencia durante la
inspiracin o disminuyndola durante la espiracin. Tambin es
importante tener presente al momento del anlisis de los flujos
umbilicales a patologas que puedan hacer variar la viscosidad
sangunea, como por ejemplo la anemia fetal.
La resistencia de la arteria umbilical disminuye con la edad
gestacional debido a una expansin fisiolgica del territorio feto-
placentario, debiendo siempre estar presente el flujo diastlico a contar
de las 16 semanas de gestacin en los embarazos normales.
4
6
Figura 6. Valores normales del IP de la arteria umbilical
IP Umbilical Arteria
0.0
0.5
1.0
1.5
2.0
22 24 26 28 30 32 34 36 38 40
Edad gestacional (semanas)
Las alteraciones descritas en la arteria umbilical se clasifican en (ver
figura 7):
- Aumento de la resistencia (ndice de pulsatilidad (IP) sobre
el percentil 95)
- Ausencia del flujo de fn de distole
- Flujo reverso en distole
Las alteraciones del flujo umbilical, despus de las 16 semanas de
gestacin, son una expresin de un aumento progresivo de la resistencia
al flujo a nivel del territorio feto-placentario. El flujo de la arteria
umbilical entre las 24 y 32 semanas de gestacin puede encontrarse
tanto ausente como reverso, varias semanas o das antes de la
interrupcin del embarazo, respectivamente.
5
Debido a lo anterior es
que la sola presencia de una alteracin de la arteria umbilical en un feto
con restriccin de crecimiento, sin la evaluacin de otros vasos fetales,
no es indicacin de interrupcin del embarazo a estas edades
gestacionales extremas.
Sin embargo, en RCF despus de las 34 semanas de gestacin, un
Doppler de la arteria umbilical anormal es inusual, pero ante la
7
presencia de un flujo fin de distole ausente o reverso la indicacin en
estos casos es interrupcin de la gestacin.
6
Figura 7. Doppler de arteria umbilical patolgico, con alta
resistencia a nivel de las vellosidades coriales, demostrado a travs del
aumento del IP y ausencia del flujo de fin de distole, respectivamente
3. VASOS ARTERIALES FETALES
3.1. Arteria cerebral media
La arteria cerebral media (ACM) se visualiza fcilmente, empleando
Doppler color o sin ste, a nivel de la medicin del dimetro biparietal,
buscando la imagen caracterstica del ala mayor del esfenoides. La
arteria cerebral media cursa a nivel del hueso anteriormente descrito
(ver figura 8). El vaso sanguneo debe ser insonado cercano al polgono
de Willis, o sea en el segmento conocido como M1. Entre algunos de los
aspectos prcticos que se debe tener en consideracin esta el tener
cuidado con presionar la cabeza fetal al momento de realizar esta
medicin, pues se puede producir un falso aumento del IP.
7
El flujo normal de la ACM muestra un flujo diastlico escaso entre
las 22 y 28 semanas de gestacin, incluso en algunos casos est
ausente o reverso. Posteriormente, el flujo diastlico persiste disminuido
hasta las 34 semanas, donde comienza progresivamente a presentarse
una redistribucin fisiolgica que lleva a una disminucin del IP de la
ACM.
8
(ver valores normales en Figura 9) Frente a cuadros hipxicos
fetales se observa una vasodilatacin compensatoria de la arteria
cerebral media, manifestada por una reduccin patolgica del IP, pero
posteriormente, frente a una descompensacin mediada por acidosis
8
metablica, se puede presentar nuevamente un alza del IP, esta vez
como un fenmeno terminal.(ver figura 10)
9
Figura 9. Valores normales del IP de la arteria cerebral media
IP arteria cerebral media
0.0
0.5
1.0
1.5
2.0
2.5
3.0
3.5
22 24 26 28 30 32 34 36 38 40
Edad gestacional (sem)
Figura 8. Doppler color del polgono de Willis y arteria cerebral
media
Figura 10. Doppler de arteria cerebral media normal y patolgica.
10
3.2. Arteria Aorta
La arteria aorta es un complemento de la evaluacin de la
hemodinamia fetal en fetos hipxicos que estn en fase de
compensacin. Este vaso, a diferencia de la arteria umbilical y cerebral
media, por su posicin anatmica es ms difcil de insonar.
Tcnicamente se puede obtener una buena onda espectral al insonar al
feto en un plano longitudinal, visualizando la aorta torxico por medio
del Doppler color (ver figura 11). Para una buena imagen espectral y
medicin del IP, es recomendable obtener este vaso con un ngulo de
insonacin menor a 60.
7
El IP de la aorta torxica se mantiene constante desde las 20
semanas en adelante, aumentando su resistencia, llegando incluso a
flujo ausente en distole, en presencia de hipoxia fetal (ver figura 12 y
13).
8
Figura 11. Demostracin por Doppler color de la arteria aorta
torxica
11
Aorta
VCI
12
Figura 13. Doppler de arteria aorta torxica normal y patolgica
Figura 12. Valores normales del IP de la arteria aorta torxica
IP aorta torxica
0.0
0.5
1.0
1.5
2.0
2.5
3.0
3.5
22 24 26 28 30 32 34 36 38 40
Edad gestacional (sem)
4. DUCTUS VENOSO
El ductus venoso comunica la vena umbilical intra-abdominal con la
vena cava inferior, y desde all, la sangre oxigenada pasa rpidamente a
la aurcula izquierda y preferencialmente al cerebro y coronarias. Este
vaso es una conexin estrecha, tipo embudo, que acelera el flujo
sanguneo venoso desde la vena umbilical (normalmente 10 cm/seg) al
menos 5 a 6 veces.
13
En una seccin medio-sagital del feto, a nivel de la aurcula
derecha, es posible reconocer el ductus venoso y diferenciarlo de los
otros dos vasos venosos, vena cava inferior y heptica, empleando
Doppler color, el cual permite reconocerlo anatmicamente y a travs
del efecto de aliasing (debido a la aceleracin del flujo se observa un
cambio del patrn de color en el Doppler), y audicin de su
caracterstico sonido.(ver figura 14)
Los valores normales del ductus venoso se expresan como ndices
de pulsatilidad venoso (S-A/Vm), equivalente al IP de los vasos
arteriales. Sus valores disminuyen con la edad gestacional, lo cual es
consistente con la disminucin de la post-carga ventricular debido a una
disminucin de la resistencia placentaria, y a una mayor capacidad
cardiaca.
8
(ver figura 15)
La onda tpica del ductus venoso, al igual que los otros vasos
venosos, tiene tres componentes (ver figura 15):
- onda S, sstole ventricular
- oda D, distole pasivo
- onda A, sstole auricular
Las alteraciones del ductus venoso se pueden clasificar en tres (ver
figuras 16):
- Elevacin del ndice de pulsatilidad venoso (IPV) sobre el
percentil 95
- Onda A ausente
- Onda A reversa
La onda A ausente o reversa durante el segundo o tercer trimestre
de la gestacin puede ser un signo de descompensacin acidtica de la
hipoxia fetal, insuficiencia cardaca secundaria a una sobrecarga
ventricular derecha, como por ejemplo en la transfusin feto-fetal, o
estadios terminales de anemia o miocarditis viral.
Figura 14. Doppler color del ductus venoso fetal
14
Figura 15. Valores normales del ductus venoso fetal
IPV ductus venoso
0.0
0.2
0.4
0.6
0.8
1.0
1.2
22 24 26 28 30 32 34 36 38 40
Edad gestacional (sem)
15
Figura 16. Doppler del ductus venoso fetal en fetos normales y
patolgicos.
16
II. UTILIDAD DEL DOPPLER EN CUADROS SECUNDARIOS A
INSUFICIENCIA PLACENTARIA, PREECLAMPSIA Y RESTRICCIN
DE CRECIMIENTO FETAL
1. DEFINICIONES
Actualmente se acepta que la preeclampsia (PE) y la restriccin de
crecimiento fetal (RCF), como tambin el parto prematuro y el
desprendimiento prematuro de la placenta normoinserta, son parte de
un sndrome clnico con distintas expresiones, caracterizado por una
hipoperfusin tero placentaria debido a una falla o dficit de la
invasin del trofoblasto extra-vellositario hacia las arterias espiraladas
maternas.
Feto pequeo para la edad gestacional (PEG) se refiere a un dficit
de alcanzar una biometra o peso estimado para una edad gestacional
especfica. Se han publicado una diversidad de puntos de referencia
para definir esta condicin, tanto expresado en percentiles o
desviaciones estndar por debajo del promedio para la edad
gestacional.
9
El grupo de fetos PEG es heterogneo, pudiendo ser
constitucionalmente pequeos (sin aumento de la morbi-mortalidad
perinatal), o ser secundarios a un dficit de su potencial de crecimiento
(RCF) debido a factores genticos, medioambientales o por reduccin
del flujo teroplacentario. Alrededor del 50-70% de los fetos bajo el
percentil 10, punto de corte ms utilizado, son constitucionalmente
pequeos, sin embargo a menor punto de referencia, mayor es la
probabilidad de encontrar fetos considerados RCF.
10;11
Los fetos PEG
tienen un mayor riesgo de presentar mortinatos,
12;13
sufrimiento fetal
agudo,
12
complicaciones neurolgicas neonatales,
12
y mayor riesgo de
diabetes tipo II e hipertensin crnica en el adulto,
14
lo cual esta
asociado a un mayor porcentaje de fetos cursando RCF.
15
La PE se caracteriza por una hipertensin, proteinuria y edema que
desaparece completamente luego del parto. Es una de las principales
causas de morbi-mortalidad durante el embarazo, y ha compartido,
con el aborto sptico, el primer lugar de stas complicaciones en
nuestro pas (20% de las muertes entre 1990 y 1996). La incidencia de
esta condicin, tanto en Chile como en el resto del mundo vara entre 4
a 6% de la poblacin de mujeres embarazadas.
16,17
Debido a que el
nico tratamiento conocido en la actualidad frente a la aparicin de
alguna de las manifestaciones de este sndrome clnico es la
interrupcin del embarazo, la tasa de parto prematuro asociado a esta
condiciones alcanza al 15%,
18
como tambin el 40% de las causas de
17
induccin del parto. Sin embargo, hasta la fecha, no se han
desarrollado medidas teraputicas capaces de prevenir o retardar la
aparicin de estas enfermedades.
19
18
2. ETIOPATOGENIA DE LA PREECLAMPSIA Y RESTRICCIN
DEL CRECIMIENTO FETAL
En los ltimos aos se han realizado una serie de avances en el
conocimiento de la etiopatogenia de la PE y sus patologas asociadas.
Sin embargo a pesar de esos avances, la fisiopatologa de este
sndrome an no ha sido establecida claramente. Por lo anterior, el
manejo de esta condicin ha sido ms bien emprico y la nica forma
de tratamiento efectivo sigue siendo la interrupcin prematura, electiva
o de urgencia, del embarazo.
19
La PE por su parte, es un desorden que
muestra una fuerte tendencia familiar, probablemente involucrando un
gen dominante mayor, con una penetracin reducida, o una herencia
multifactorial.
20
Existe tambin un elemento inmunolgico anti-
paterno, fundamentado en que la enfermedad es ms comn en el
primer embarazo, luego de un cambio de pareja o una breve vida
sexual antes de la gestacin con PE.
21
Existe otra hiptesis que plantea
que la PE sera una respuesta exagerada a un proceso inflamatorio
materno, mediado por un gatillamiento placentario inicial, el cual
posteriormente producira las reacciones sistmicas maternas que
llevaran a la aparicin de los sntomas y signos clnicos caractersticos
de esta enfermedad.
22
ORIGEN PLACENTARIO
Desde hace 100 aos que se conoce que la PE es una condicin
placentaria.
23
La placenta es el elemento fundamental para la aparicin
de PE y RCF. Sin embargo, solamente entre un 5 a 10% de las mujeres
presentan estos cuadros clnicos. Por lo tanto, una reduccin relativa del
flujo tero-placentario, secundaria frecuentemente a una alteracin de
la placentacin, es lo que conduce al desarrollo de estas patologas.
24;25
Se ha visto que en ambas condiciones existen similares alteraciones
histopatolgicas en el sitio de implantacin placentario. Brosens y col.,
estudiando biopsias del sitio de insercin placentaria llegaron a la
conclusin de que en ms del 80% haba un dficit del fenmeno de
invasin fisiolgica del trofoblasto extravellositario en las arterias
espiraladas maternas.
26
Este hallazgo fue corroborado por Khong y col
27
quienes encontraron que en el 100% de las mujeres con PE exista una
ausencia de las modificaciones fisiolgicas de las arterias espiraladas,
mientras que este fenmeno se vio solamente en 75% de los fetos
catalogados como RCF (<percentil 10).
La placentacin fisiolgica comprende dos etapas, la primera donde
predomina un citotrofoblasto con fenotipo de proliferacin hasta las 12
semanas de gestacin, caracterizndose por una hipoxia relativa, con
aumento del factor de transcripcin inducido por la hipoxia (HIF-1),
19
aumento del transformador del factor de crecimiento (TGF-3), aumento
de citoquinas inflamatorias y aumento del factor de crecimiento vascular
(VEGF).
28
La segunda etapa, que comenzara a las 12 semanas de
gestacin, consistira en un cambio del citotrofoblasto de las
vellosidades troncales hacia un fenotipo invasor (trofoblasto
extravellositario), el cual es mediado por cambios en la concentracin
parcial de oxgeno en el espacio intervelloso. Estas modificaciones llevan
a una disminucin del HIF-1 y TGF-3.
29
Por el contrario, en las patologas con alteracin de la placentacin
la invasin trofoblstica es inadecuada y limitada solamente a las
arterias espiraladas presentes en la decidua superficial. Los mecanismos
involucrados en esta alteracin son an desconocidos, pero se han
planteado entre otros por ejemplo el reconocimiento inmune materno,
30
aumento del HIF-1, aumento del TGF-3
31;32
, disminucin del factor de
crecimiento placentario (PlGF)
33;34
, aumento receptor soluble de
VEGF/PlGF (sFlt1),
35
y disminucin NO.
36
Desde el punto de vista de la RCF, en estudios realizados por el
grupo del Kings College Hospital de Londres
37;38
se encontr una
asociacin entre la disminucin del flujo tero-placentario y umbilical,
medido a travs de la velocimetra Doppler, y la presencia de
hipoxemia, hipercapnia y acidosis fetal. Estos estudios confirman los
hallazgos histopatolgicos encontrados en fetos con RCF de una
alteracin en la placentacin y reduccin del nmero de vellosidades
coriales terminales o vellosidades de intercambio.
39;40
Las diversas hiptesis planteadas para estos cuadros clnicos
aceptan que La invasin del trofoblasto extravellositario es defectuoso
en PE y RCF,
41
llevando a que la circulacin tero-placentario
permanezca en un estado de alta resistencia durante la gestacin, la
cual puede ser detectada clnicamente por la velocimetra Doppler de las
arterias uterinas,
1
manifestndose por un aumento de la resistencia de
estos vasos. La persistencia de un estado de sub-perfusin placentaria
llevara a hipoxia placentaria, estrs oxidativo y, en muchos casos,
infartos del tejido placentario. Estos cambios bioqumicos conduciran a
la liberacin de un factor(es) elusivo(s) que al ganar acceso a la
circulacin materna producira una disfuncin vascular.
42
La alteracin de la migracin del trofoblasto, como hemos
analizado, no es slo caracterstica de la PE, sino que tambin de la RCF,
desprendimiento prematuro de la placenta, parto prematuro e
hipertensin crnica durante la gestacin. Por lo tanto, se ha propuesto
que se necesitaran factores adicionales para el desarrollo de una u otra
condicin de este sndrome clnico. La PE, por ejemplo, se asociara
principalmente a vasculopata materna preexistente,
43
factor gentico
paterno
44
o materno.
20
20
DISFUNCION ENDOTELIAL
La extraordinaria variabilidad de este sndrome clnico se debera al
gran disturbio circulatorio mediado por la disfuncin de las clulas
endoteliales maternas. Cuando se propuso por primera vez la hiptesis
de que la PE se caracterizaba esencialmente por una disfuncin
endotelial fue considerado un gran avance en el conocimiento de la
gnesis de este sndrome clnico.
45
Sin embargo, en la actualidad ha
surgido el concepto de que en la mujer embarazada con este sndrome
clnico existira una susceptibilidad especial o disfuncin endotelial pre-
existente (enfermedades crnicas). Esto podra explicar las diferentes
manifestaciones clnicas asociados a este sndrome.
Evidencias de la disfuncin endotelial son la demostracin de un
aumento de la concentracin plasmtica de marcadores dao endotelial.
Entre ellos es importante destacar al factor de von Willebrand, al
activador del plasmingeno tisular y a los inhibidores del activador del
plasmingeno endotelial y placentario (PAI-1 y 2)
46;47
que preceden al
establecimiento clnico de estas enfermedades. Chappel y col.
48
emplearon marcadores del dao endotelial y funcin placentaria con la
intencin de evaluar el efecto de los antioxidantes en la prevencin de
PE en pacientes con alto riesgo de presentar esta patologa. El dao
endotelial y la funcin placentaria fueron evaluado por medio de la
relacin entre el inhibidor del activador del plasmingeno 1 (PAI-1),
sintetizado predominantemente por el endotelio, y el PAI-2, sintetizado
por la placenta. Se observ que los niveles plasmticos de PAI-1
aumentan progresivamente durante la gestacin normal y ms an en
las pacientes con PE.
47
Por otro lado, los niveles de PAI-2 aumentan
progresivamente durante la gestacin normal, pero disminuyen cuando
existe una alteracin de la funcin placentaria.
47
La relacin de PAI-
1/PAI-2 disminuye en el embarazo normal debido al aumento de la
masa placentaria, sin embargo esta relacin aumenta en PE debido a la
activacin celular e insuficiencia placentaria
49
.
El dficit de xido ntrico (NO) ha sido involucrado en la gnesis de
PE
50
y en especial en este ltimo tiempo el aumento de la dimetil-
arginina asimtrica (ADMA), inhibidor competitivo de la xido ntrico
sintetiza (eNOS)
51
, el cual se ha asociado tambin al aumento del estrs
oxidativo mediado por la inactivacin de su enzima metabolizadora
dimetil-aminotransferasa (DDAH 1 y II)
52
.
Otras evidencias de la alteracin de la funcin endotelial se han
descrito en arterias aisladas provenientes de pacientes con PE. McCarthy
y col
53
, empleando arterias obtenidas de la piel de mujeres PE, mostr
una alteracin de la respuesta vasodilatadora a la acetilcolina (Ach), la
cual fue dependiente de endotelio. Posteriormente, Knock y col.
54
evaluaron la respuesta a bradiquinina (BK) en los mismos vasos, y
encontraron, al igual que con Ach, una alteracin de la relajacin a BK
21
en las arterias aisladas de madres con PE. Por el contrario, Pascoal y
col.
55
informaron una disminucin de la relajacin mediada por Ach y no
por BK en arterias del omento mayor proveniente de pacientes PE,
sugiriendo que sto no estara relacionado con la produccin de xido
ntrico o prostaciclina. Recientemente, se encontr una menor respuesta
a Ach en arterias intramiometriales aisladas de PE en comparacin a
embarazadas normotensas,
56
ambos grupos de arterias fueron mediados
por xido ntrico.
La hiper-homocisteinemia tambin ha sido asociada a dao
endotelial, promocin de estrs oxidativo, dficit de NO y
prostaciclina
57;58
y alteracin de la cascada de la coagulacin.
59
Recientemente, se ha publicado que un 20-30% de las mujeres con PE
presentan un aumento de la concentracin plasmtica de homocisteina
60
y tambin aquellos complicados con RCF
61
. En un metanlisis de una
serie de estudios observacionales, se concluy que la
hiperhomocisteinemia y el dficit de folato, no as la disminucin de
vitamina B12, seran factores de riesgo de PE
62
. Finalmente, algunos
autores han demostrado una elevacin de homocistena que precede la
aparicin de los signos clnicos de la enfermedad
63
, mientras que otros
no los encontraron elevados.
64
ROL DEL ESTRS OXIDATIVO
El endotelio vascular es altamente sensible al efecto de radicales
libres. Estas sustancias pueden causar daos a nivel de las mitocondrias
y ADN del endotelio, como tambin reaccionar con el xido ntrico para
formar peroxinitritos,
65
los cuales son sustancias altamente dainas para
el organismo. Existen amplias evidencias que sugieren que la PE es un
estado de estrs oxidativo. Se ha observado que los marcadores
bioqumicos de lipoperoxidacin, tales como malondialdehido
66
y los
isoprostanos,
67
estn elevados en mujeres con PE; mientras que las
concentraciones plasmticas
68
y placentarias
69
de vitaminas E y C estn
disminuidas, reflejando una disminucin de la capacidad antioxidante de
esta condicin patolgica del embarazo.
Adems del estrs oxidativo, las dislipidemias podran contribuir a la
disfuncin endotelial. La concentracin de lpidos plasmticos cambia
dramticamente en el embarazo normal: se observa un aumento del
colesterol (tanto LDL y HDL), cidos grasos y triglicridos
70
. En PE se
observa una mayor elevacin de la concentracin de cidos grasos libres
y triglicridos y una elevacin de la relacin del colesterol LDL/HDL.
71
Por medio de la medicin de dienos conjugados, malondialdehido y
movilidad electrofortica relativa se ha observado un aumento de lpidos
peroxidados en PE.
72
Una mayor evidencia se ha observado con el
aumento de la concentracin plasmtica de 8-iso-prostaglandina F
2
(8-
iso-PG-F
2
) en pacientes pre-eclmpticas.
67
El 8-iso-PGF
2
es una
22
familia de compuestos denominados isoprostanos, que se forman a
partir de la peroxidacin del cido araquidnico,
73
y que son potentes
vasocontrictores en el rin, pulmn, corazn y placenta.
74
El
descubrimiento de los isoprostanos y la presencia de exmenes
confiables para su evaluacin, representan un gran avance en el
diagnstico de estrs oxidativo en condiciones patolgicas. Adems, los
isoprostanos son tambin tiles en la evaluacin del efecto de terapias
antioxidantes. As, se ha observado que la ingesta de vitamina E y C
reduce la concentracin plasmtica de 8-iso-PGF
2
en fumadores.
75
El estrs oxidativo en PE se caracteriza tambin por la disminucin
de la concentracin plasmtica de antioxidantes, tales como vitamina
C
76
y vitamina E.
68;77
Tambin se ha observado una disminucin de
Beta-caroteno
78
y de la actividad de enzimas antioxidantes tales como
glutatin peroxidasa,
79
glucosa 6-fosfato deshidrogenasa y el superxido
dismutasa.
80
Todo lo anterior apoya la hiptesis de que la
hipoxia/isquemia de la placenta podra ser una importante fuente de
radicales libres.
71
Recientemente, Moretti y col demostraron un aumento de estrs
oxidativo en PE empleando una tcnica no-invasiva a travs de la
exhalacin
81
, y Stepan y col tambin mostraron aumento de estrs
oxidativo, empleando una tcnica de aplicabilidad simple, en el grupo de
pacientes con Doppler de arteria uterina alterada, o sea con hipoxia
utero-placentaria
82
.
Leptina. Leptina es una hormona que se expresa en forma
abundante y especfica en el tejido adiposo, reduciendo la ingesta y el
peso corporal por medio de su receptor en el hipotlamo.
83
La leptina
tambin se sintetiza en otros tejidos, como el trofoblasto placentario.
84
La leptina est aumentada en los embarazos con PE, y su gnesis puede
estar relacionada con el aumento de la resistencia a la insulina
85
a nivel
del tejido adiposo o por aumento de la masa placentaria. Sin embargo,
la presencia de hipoxia, secundaria a la alteracin de la placentacin,
sera la causa ms probable de aumento de leptina en PE
86
. Grosfeld y
col. demostraron en un estudio de cultivos celulares expuestos a
hipoxia, que el aumento de HIF-1 induce el gen de leptina.
87
Otros
factores que estaran mediando el aumento de leptina en PE, sera el
hecho de que sta es miembro de la familia de las citoquinas, y segn la
teora de Redman y col
22
la PE es una exacerbacin de la respuesta
inflamatoria materna que llevara a una activacin endotelial y
leucocitaria.
Las consecuencias de la elevacin de la leptina en las mujeres con
PE pueden ser beneficiosas o dainas, entre ellas destaca el aumento de
la sntesis de factores angiognicos como el VEGF y PlGF,
88
y el aumento
de NO.
89
Por el contrario, leptina aumenta la sntesis de superoxido
23
mitocondrial en cultivo de clulas endoteliales, este hallazgo se asociara
a que el aumento de la concentracin de leptina llevara a mayor dao
endotelial y estrs oxidativo
90
. En un estudio que demostr la
disminucin de PE en presencia de vitaminas antioxidantes, aunque no
con el poder estadstico suficiente, la concentracin de leptina tambin
disminuy con el uso antioxidantes
91
, al igual que el F
2
-isoprostano
(expresin de lipo-peroxidacin).
Finalmente, desde un punto de vista fetal, la concentracin de
leptina est disminuda en fetos con RCF y sin PE,
92
por lo tanto, la
elevacin de la concentracin de leptina observada en PE, sera una
respuesta adaptativa de esta enfermedad con el objetivo de mantener el
crecimiento fetal en rangos normales.
FACTORES ANGIOGNICOS EN LA GNESIS DE LA ALTERACIN DE
LA MIGRACIN DEL TROFOBLASTO
El factor de crecimiento vascular (VEGF) y placentario (PlGF) son
factores de crecimiento endoteliales, cuya principal accin es la
promover la vasodilatacin va prostaciclina y xido ntrico, y la
proliferacin de clulas endoteliales.
93;94
Este efecto lo hacen al unirse
con sus receptores de membrana, fms-like tyrosine1 (Flt-1 o VEGF-R1)
(para ambos factores) o KDR/Flk-1 (VEGF-R2) (slo VEGF).
94
Se ha
descrito la existencia en el plasma de una protena producto del
splicing alternativo del gen FLT-1, demoninada sFlt-1.
95
Esta protena
est constituida slo por los dominios extracelulares de Flt-1, por lo que
su accin sera de ligar VEGF/PlGF, actuando como protena
transportadora, de este modo disminuyendo la biodisponibilidad de
estos factores en plasma.
94;95
Gracias a estudios en modelos de cncer se ha visto que al
administrar suero anti-VEGF a pacientes en tratamiento de cncer, estos
pacientes desarrollan un cuadro similar a la PE, presentando
hipertensin arterial y proteinuria en rango nefrtico.
96;97
Lo mismo ha
sido demostrado en modelos de ratas embarazadas o no, que al
administrarles en forma exgena el receptor soluble, sFlt-1, presentaban
un cuadro similar a la PE, con lesiones a nivel de rin similares a las
descritas en esta patologa.
35;98
Estos fenmenos se acompaaron de un
descenso en los niveles plasmticos de VEGF y PlGF.
Recientemente fueron publicadas las curvas normales de VEGF,
PlGF y sFlt-1 durante el embarazo.
98
Se observ que dos meses antes
del trmino del embarazo se produca un aumento en los niveles de sFlt-
1, acompaado de un descenso en el nivel de PlGF. Los niveles de VEGF
se mantuvieron en rangos estables durante el embarazo. En el grupo de
PE se observ que estos cambios ocurran en forma precoz y de mayor
magnitud, encontrando niveles elevados de sFlt-1 cinco semanas antes
de las manifestaciones clnicas de PE, y niveles bajos de PlGF desde las
24
semana 13 de gestacin en adelante. Tambin se observ que mientras
ms precoz e intenso eran estos cambios peor era el resultado perinatal,
asocindose a la gran mayora de ellos a RCF.
98
En contraposicin con Ong y col
99
, recientemente se demostr que
PlGF est significativamente aumentado a las 12 semanas de gestacin
en mujeres que presentaron posteriormente PE y RCF, sto no se
observ en el receptor soluble sFlt-1. Sin embargo, estos datos son an
poco consistentes, tanto por el nmero de casos incorporados en el
estudio y por la alta variabilidad de los datos de las pacientes
normales.
98
Estudios inmunohistoqumicos en placenta han permitido
determinar que el receptor VEGF-R1 se ubica en el sinciciotrofoblasto,
en cambio el receptor VEGF-R2 se encuentra en el endotelio de los
vasos placentarios. Estos estudios revelaron una alta expresin de
VEGF-R1 en las placentas de mujeres con PE severa y RCF, acompaado
lo anterior de una baja concentracin plasmtica de PlGF en las madres
PE.
100
25
3. PREDICCIN DE PREECLAMPSIA Y RESTRICCIN DE
CRECIMIENTO FETAL
3.1. Mtodos clnicos y laboratorio de deteccin precoz de PE
y RCF
Muchos mtodos han sido propuestos para predecir la aparicin de
PE. A continuacin se sealan algunos mtodos que han sido utilizados
con este propsito:
A. Factores de riesgo de la historia clnica y embarazo
actual.
Los factores pre-concepcionales y/o patologas crnicas cabe
mencionar la primipaternidad, exposicin espermtica limitada y padres
con antecedentes de PE con otra pareja. Entre los factores asociados a
la madre destacan la historia previa de PE, edad materna, intervalo
gestacional e historia familiar. Entre las patologas crnicas asociadas a
PE estn la hipertensin esencial, obesidad, diabetes gestacional y
mellitus tipo I, dficit protena S y resistencia protena C, anticuerpos
antifosfolpidos e hiperhomocisteinemia. Por ltimo, existen factores
durante la gestacin que se asocian mayormente con PE como son el
embarazo mltiple, las malformaciones congnitas, hidrops fetal,
cromosomopatas y mola hidatiforme. La deteccin clnica de estos
factores de riesgo pre-gestacionales y asociados al embarazo podran
eventualmente ayudar a realizar una prevencin primaria de esta
patologa.
101
B. Presin arterial:
Su medicin ha demostrado escasa utilidad en la prediccin de esta
condicin.
102
Aunque una elevacin de la presin arterial diastlica o
presin arterial media en el segundo trimestre puede predecir
adecuadamente la aparicin del sndrome hipertensivo del embarazo,
este cambio no est asociado a una mayor morbi-mortalidad
perinatal.
103
C. cido rico:
La uricemia se ha empleado como un indicador de la severidad de la
PE y sera un mejor predictor que la presin arterial de mal pronstico
26
perinatal.
104
Pero la baja sensibilidad de este test, encontrada en
muchos estudios, ha hecho que su uso no se haya masificado
mayormente.
105
D. Marcadores bioqumicos:
La determinacin de marcadores bioqumicos de utilidad en el
tamizaje de PE y RCF se basa en los elementos etiopatognicos
anteriormente discutidos. La reduccin del flujo tero-placentario no es
capaz de explicar por si sola la etiopatogenia de la PE. La placentacin
anormal debe interaccionar con factores constitucionales maternos en
la gnesis de este sndrome clnico, y esto queda de manifiesto en los
casos de RCF sin PE, los cuales comparten la misma alteracin de
placentacin que la PE
27
, pero sin los factores maternos que
predispongan a esta condicin
106
. Es posible diferenciar marcadores
sricos o plasmticos en tres distintas fases: precoces, intermedios y
tardos.
107
Factores precoces: responsables de una migracin/invasin
trofoblstica inadecuada. Los niveles de estos factores en la circulacin
materna pueden o no reflejar sus niveles in situ. Los marcadores
bioqumicos que se han estudiado en el segundo trimestre del
embarazo en base a estudios longitudinales prospectivos,
retrospectivos y caso-control son:
108-110
- Hipoxia placentaria y estrs oxidativo: Leptina, Ac
rico, Ac. Ascrbico, PlGF
- Alteracin placentacin: Ag PAI-2, PAI-1/PAI-2,
VCAM y ICAM, Inhibina
Factores intermedios: estos factores aparecen en la circulacin
materna como resultado de una disminucin de la perfusin placentaria
y activacin endotelial. Estos factores estn presentes en el plasma o
suero materno antes de la aparicin de los signos clnicos de la
enfermedad. Estos marcadores bioqumicos son:
111
- Dficit de placentacin: TGF-1 y 3, PAI-1, PAI-2
- Estimulado por hipoxia placentaria o estrs oxidativo:
Leptina, Endotelina-1, ADMA, F
2
-isoprostano y MDA (lipo-
peroxidacin), Nitrotirosina, Homocisteinemia, Ac Flico y vit
B12, VEGF, PlGF, Ac rico
Factores tardos: Su aparicin es ms bien considerada una
consecuencia de la activacin y/o disfuncin endotelial
- Vasoconstriccin: Neurokinina-B, neuropptido Y, ET-
1, ADMA
27
- Compensacin por vasoconstriccin: NO
- Alteracin funcin endotelial: VEGF, IL-12, TNF,
IL-6, VCAM-1
- Alteracin funcin renal: Ac rico
28
E. DOPPLER DE LAS ARTERIAS UTERINAS COMO
PREDICTORES DE PREECLAMPSIA Y RESTRICCIN DE
CRECIMIENTO FETAL
La invasin trofoblstica de las arterias espiraladas maternas es la
base anatomo-patolgica clave de la PE y RCF
112
. La flujometra
Doppler es una tcnica no-invasiva que mide la velocidad de los flujos
sanguneos e indirectamente su resistencia. La pesquisa de PE y RCF
por medio de flujometra Doppler de las arterias uterinas en
poblaciones no seleccionadas ha mostrado resultados variables, debido
esencialmente a las diferentes edades gestacionales al momento del
examen, la metodologa empleada, y las definiciones de mal resultado
perinatal.
113-116
Se ha descrito su uso en dos etapas, 20 y 24 semanas de
gestacin, con el objetivo de seleccionar a un grupo de alto riesgo de
desarrollar PE y RCF.
117
Harrington y col.,
118
empleando el mismo
mtodo, encontraron que el 4% de la poblacin de mujeres
embarazadas presentaban aumento de la resistencia de las arterias
uterinas a las 24 semanas de gestacin, el cual contena al 55% y 30%
de las embarazadas que desarrollaran PE y RCF, respectivamente. En
dos trabajos recientes, donde realizaron solamente flujometra Doppler
color a las 23 semanas de gestacin, clasificaron como poblacin de
alto riesgo de PE y RCF al 5% de las mujeres embarazadas.
119;120
Aproximadamente el 90% y 60% de stas desarroll PE y RCF,
respectivamente, antes de las 34 semanas de gestacin.
Nuestro grupo, en la Unidad de Medicina Fetal del Hospital Clnico
de la Universidad de Chile, est realizando un estudio prospectivo de la
utilidad del Doppler de arterias uterinas en el cribado de preeclampsia
y restriccin de crecimiento fetal, y ha encontrado resultados similares
a los descritos en la literatura internacional, tanto a las 12 como a las
23 semanas de gestacin.
4
El Doppler de arteria uterina se realiz
tanto a las 11-14 y/o 22-25 semanas de gestacin a todas las
pacientes incorporadas al proyecto. El percentil 95 del ndice de
pulsatilidad (IP) promedio de ambas arterias uterinas, parmetro
aceptado para determinar el riesgo de insuficiencia placentaria,
disminuye significativamente con la edad gestacional, siendo de 2,43 a
las 12 semanas y 1,54 a las 23 semanas. La sensibilidad en la
deteccin de PE global a travs de los parmetros anteriores fue de
45,2% (14/31) a las 23 semanas y 30% (3/10) a las 12 semanas. Sin
embargo, al igual que varias descripciones en la literatura
internacional, la sensibilidad de este prueba mejora enormemente
cuando se emplea para detectar PE severas (interrupcin del embarazo
29
<35 semanas): 50% (2/4) y 91% (10/11) a las 12 y 23 semanas,
respectivamente.
En las tablas I y II se observa un significativo aumento del
promedio del IP de la arteria uterina, medido a las12 y 23 semanas, en
el grupo de pacientes que desarrollaron PE y RCF comparado con los
controles. Adems, se observ una correlacin inversamente
proporcional con la edad gestacional al parto y el peso del recin
nacido (r= -0,41 y 0,28; p<0,001).
Tabla I. Resistencia de arteria uterina en normales y patolgicas
entre 11 y 14 semanas
Grupo N Mediana
(IP)
IC (25%-
75%)
Control 4
94
1,51 1,21-1,85
Preeclam
psia
1
3
1,87* 1,51-2,27
RCF 2
9
1,66 1,41-2,02
* p<0,05 Kruskal Wallis y Mann-Whitney entre PE y Control
Tabla II. Resistencia de arteria uterina en normales y patolgicas
entre 22 y 25 semanas
Grupo N Mediana
(IP)
IC (25%-
75%)
Control 7
26
0,94 0,83-1,11
Preeclam
psia
3
1
1,53* 1,11-1,66
RCF 4
2
1,15* 1,00-1,45
* p<0,05 Kruskal Wallis y mtodo de Dunn versus control
Por ltimo, Chien y colaboradores realizaron una rigurosa revisin
de 27 estudios y 12.994 embarazadas, donde se emple Doppler de las
arterias uterinas como un predictor de PE y RCF. Aunque se concluy
que este examen tiene una moderada habilidad en predecir estas
patologas, un Doppler anormal en el segundo trimestre del embarazo
aumenta el riesgo de presentar PE en 6 veces, hacindolo por lo tanto
clnicamente relevante tanto para la madre como para el mdico
tratante.
121
30
Finalmente, en el siguiente esquema se pueden integrar los
distintos marcadores bioqumicos y hemodinmicas analizados hasta el
momento en la prediccin de patologas asociadas a insuficiencia
placentaria:
Figura 17. Esquema de cribado de preeclampsia y restriccin de
crecimiento fetal empleando marcadores bioqumicos y Doppler de
arteria uterina
31
4. MANEJO DE LA RESTRICCIN CRECIMIENTO FETAL
4.1. Arteria umbilical
Estudios patolgicos de la placenta han demostrado que el aumento
de la impedancia de la arteria umbilical se hace evidente cuando al
menos un 60% de la red vascular esta obliterada.
40
Lo anterior se ha
asociado con alteraciones morfolgicas de las vellosidades coriales
terminales caracterizada entre otras por una disminucin del nmero de
capilares y ramificaciones de las vellosidades coriales terciarias de las
vellosidades terciarias.
Varios estudios clnicos demostraron el aumento progresivo de la
resistencia de la arteria umbilical en embarazos con RCF, llegando
incluso a presentar flujo diastlico ausente o reverso.
122
En un estudio en sangre fetal obtenida a travs de cordocentesis en
fetos con restriccin del crecimiento y ausencia de flujo diastlico en la
arteria umbilical, se encontr hipoxia y acidosis en 80% y 46%
respectivamente. Por el contrario, en RCF con presencia de distole en
arteria umbilical, slo 12% fue hipoxmico y ninguno acidmico.
37
Un estudio multicntrico clasific a su poblacin de alto riesgo en
tres grupos de acuerdo a la morfologa de la arteria umbilical: distole
presente, ausente y reverso. La mortalidad perinatal global fue de 28%,
sin embargo este riesgo fue 10 veces superior en las pacientes con flujo
diastlico reverso comparado con los normales. Adems, el grupo con
flujo ausente o reverso tuvo mayor probabilidad de hospitalizarse en la
Unidad de Cuidados Intensivos Neonatales (UCIN), mayor incidencia de
hemorragias intracranealas, anemia, hipoglicemia y dao neurolgico a
largo plazo.
172
Un meta-anlisis de 12 estudios randomizados y controlados
123
del
papel del Doppler de arteria umbilical en el manejo de embarazos de
alto riesgo demostr las siguientes diferencias con el grupo que no
emple este recurso:
- 44% reduccin de ingresos a la UCIN (IC: 28-57%)
- 20% reduccin de induccin de trabajo de parto (IC: 10-
28%)
- 52% reduccin de tasa de cesrea por sufrimiento fetal (IC:
24-69%)
- 38% reduccin de mortalidad perinatal en el grupo que se
utiliz esta informacin para el manejo de la RCF (IC: 15-55%)
32
La informacin anterior avala el uso del Doppler de la arteria
umbilical en todas las pacientes que estn cursando embarazos de alto
riesgo, incluidas aquellas con preeclampsia y restriccin de crecimiento
fetal.
Varios autores que han seguido longitudinalmente a embarazos con
RCF y han encontrado que la arteria umbilical se altera alrededor de 4
semanas antes de la aparicin de los signos hipxicos/acidticos en la
monitorizacin de la frecuencia cardaca fetal.
5;124;125
4.2. Redistribucin arterial fetal
Los fetos hipoxmicos presentan una redistribucin del flujo
sanguneo, el cual se manifiesta con un aumento de ste hacia el
cerebro, miocardio y glndulas suprarrenales; y una disminucin hacia
los riones, tracto gastrointestinal y extremidades inferiores.
126
Aunque
los mecanismos involucrados en el control de los ajustes vasculares de
los fetos hipxicos se conocen solo parcialmente, se piensa que la
presin parcial de oxgeno y el dixido de carbono juegan un papel al
estimular a quimiorreceptores. Sin embargo, los mecanismos de
vasodilatacin cerebral son limitados, alcanzando su nadir (mxima
disminucin del ndice de pulsatilidad) alrededor de dos semanas antes
de la aparicin de las desaceleraciones tardas.
127
Por otro lado, Vyas y
cols. encontraron un aumento abrupto de la resistencia de la arteria
cerebral media luego de un periodo de vasodilatacin extrema en fetos
extremadamente hipxicos, hecho que podra ser secundario a la
presencia de edema cerebral, reduccin en el dbito cardaco, y
alteraciones a nivel endotelial y de la musculatura lisa vascular.
128
Los vasos arteriales fetales y placentarios son extremadamente
tiles en el diagnstico diferencial y manejo de casos de fetos pequeos
para la edad gestacional y/o restriccin de crecimiento fetal. En el grupo
hipoxmico, debido a un dficit en la placentacin fisiolgica se produce
un aumento de la resistencia de la arteria umbilical, el cual se acompaa
de una disminucin de la resistencia de la arteria cerebral media,
expresin de redistribucin del flujo arterial. Directamente relacionado
con los cambios anteriores, se produce un aumento de la relacin
cerebro-placentaria, relacin entre los ndices de pulsatilidad de la
arteria umbilical y cerebral media (AU/ACM). La alteracin de la relacin
AU/ACM se ha asociado a un aumento de la morbi-mortalidad perinatal y
a una mejor prediccin del grupo de mayor riesgo perinatal que la
arteria umbilical por s sola.
129;130
Sin embargo, la relacin entre la aorta
torxica descendente y la arteria cerebral media (ATD/ACM) refleja de
mejor manera el pronstico de los fetos hipxicos despus delas 34
semanas de gestacin que la relacin AU/ACM.
131
33
4.3. Doppler cardiaco fetal
Durante los fenmenos de redistribucin fetal en la hipoxia
intrauterina se observa al mismo tiempo una disminucin de la
postcarga del ventrculo izquierdo, secundario a la vasodilatacin
cerebral, y un aumento de la postcarga en el ventrculo derecho debido
a un aumento de la resistencia placentaria y sistmica. Adems, la
hipoxemia per se altera la contractilidad cardaca y la policitemia
produce una disminucin de la precarga.
132
Por lo tanto, estos
fenmenos hemodinmicas se expresan por un aumento de la relacin
entre el llenado lento y rpido ventricular (relacin E/A),
133
disminucin
de la velocidad mxima de la arteria aorta y pulmonar,
134
y aumento
relativo del debito cardaco del ventrculo izquierdo y disminucin del
derecho.
135
Estudios longitudinales en fetos con RCF muestran que la
contractilidad miometrial intrnseca juega un papel preponderante en la
mantencin de la funcin hemodinmica, la cual se daa
dramticamente alrededor de una semana antes del compromiso fetal
terminal.
4.4. Doppler venoso fetal
En estudios realizados en animales sometidos a hipoxia se ha
demostrado que el flujo venoso umbilical se dirige preferencialmente
hacia el ductus venoso, a expensas del flujo hacia el hgado,
aumentando, por lo tanto, el dbito cardaco. El flujo sanguneo derivado
hacia el miocardio y cerebro se duplica en la fase de redistribucin
arterial.
136
El flujo venoso hacia el corazn se caracteriza por la
presencia de tres ondas (S, D y A) y es controlado esencialmente por
tres factores. La primera onda, S, tiene relacin con el flujo eyectivo del
ventrculo izquierdo, produciendo un aumento del flujo venoso hacia el
corazn, posteriormente se observa nuevamente una onda eyectiva
anterograda, D, correspondiendo a una disminucin de la postcarga del
ventrculo derecho, la cual favorece el llenado ventricular. Finalmente,
se observa un flujo retrogrado relativo durante el sstole auricular (A). El
aumento de la resistencia sistmica y placentaria, observada en la
redistribucin arterial fetal, produce un aumento de la postcarga del
ventrculo derecho y secundario a ello un aumento de la presin de fn
de distole. Los cambios progresivos y secuenciales observados en los
flujos venosos se caracterizan primariamente por un aumento de la
profundidad de la onda A u onda reversa (sstole auricular),
34
fisiolgicamente observada en la vena cava inferior, posteriormente un
aumento de la relacin S/A en el ductus venoso y finalmente la aparicin
de las pulsaciones de la vena umbilical.
137
Este patrn es
contemporaneo con la aparicin de patrones anormales en la
monitorizacin electrnica, acidemia y alteraciones endocrinolgicas
caractersticos de las etapas terminales en los fetos con RCF.
138
La evaluacin de los vasos venosos fetales es til en la
monitorizacin de restricciones de crecimiento fetal con redistribucin
arterial. Una hemodinamia normal a nivel venoso nos habla de un
mecanismo de compensacin adecuado, por el contrario, una alteracin
de estos parmetros nos da cuenta de fenmenos de descompensacin.
Hecher y cols.
129
observaron que en un subgrupo de fetos con RCF y
redistribucin arterial, los cambios en los patrones venosos son mejores
predictores de mal pronstico que el perfil biofsico.
A diferencia de los cambios observados en los vasos arteriales, las
modificaciones en los vasos venosos se asocian temporalmente con el
compromiso fetal severo. Un estudio donde se realiz cordocentesis a un
grupo de fetos con restriccin de crecimiento severa se observ que el
parmetro que tiene una mayor correlacin con acidemia es el ductus
venoso,
129
como as tambin fue el parmetro que mejor se asoci con
mortalidad perinatal y Apgar bajo a los 5 minutos.
139
Como se ha discutido anteriormente existen dos mecanismos que
probablemente expliquen la alteracin del flujo venoso: aumento de la
postcarga del ventrculo derecho y alteracin de la funcin miocrdica.
En la medida que la redistribucin arterial mantenga un flujo
preferencial hacia las arterias coronarias, a pesar del aumento de la
postcarga del ventrculo derecho, se retrasarn las alteraciones
anteriormente sealadas. En esta etapa los fetos con RCF muestran
alteracin del Doppler de la arteria umbilical con redistribucin arterial,
pero con ductus venoso, monitorizacin electrnica y perfil biofsico
normales. Los cambios progresivos del ductus venoso manifiestan
gradualmente una insuficiencia cardaca debido al dao hipxico que se
produce sobre la funcin miocrdica.
4.5. Momento de interrupcin
A pesar de los avances en el conocimiento de la etiopatogenia de la
restriccin de crecimiento fetal an existen controversias en cuanto al
momento de la interrupcin en casos con RCF severa (bajo 33
semanas). La disyuntiva se plantea entre la interrupcin antes de la
aparicin de signos de hipoxemia severa, con el consecuente riesgo de
complicaciones neonatales asociadas a prematurez, o retrasar esta
35
interrupcin, con las consecuentes complicaciones fetales asociadas a la
malnutricin e hipoxia intrauterina.
Estudios de seguimientos de casos clnicos de RN con RCF y Doppler
de arteria arta torxico anormales mostraron solo un leve dficit
intelectual y daos neurolgicos.
140;141
Si estos datos se confirmaran en
estudios prospectivos controlados por diversos factores confundentes
tales como, grado de prematurez, crecimiento fetal, y manejo, sera
recomendable interrumpir estos embarazos antes de la aparicin de
signos de alteracin en la aorta torxica. Por otro lado, los datos que se
tienen hasta la fecha en las pacientes con Doppler de arteria cerebral
media alterada, muestran que no existe un mayor compromiso
neurolgico, moderado o severo, que sus controles a los 2 aos de
vida.
142
Por lo tanto, an es necesario contar con ms elementos, fetales
y neonatales, para informar adecuadamente a los padres de los pro y
contras de postergar o interrumpir un embarazo con RCF severa antes
de las 33 semanas de gestacin.
El mecanismo de compensacin de la redistribucin de flujo arterial
fetal hacia el cerebro, corazn y suprarrenales permiten al feto evitar un
mayor dao secundario a la hipoxia intrauterina. Cuando esta
compensacin llega a su lmite fisiopatolgico, la descompensacin
puede ocurrir rpidamente. La alteracin del flujo sanguneo a travs del
ductus venoso nos marca un punto de inflexin que podra conducir a la
interrupcin iatrognica del embarazo afectado.
La secuencia lgica de la alteracin de los flujos sanguneos tanto
en la placenta como en el feto son los siguientes: aumento de la
impedancia del flujo de la arteria umbilical, evidencias de redistribucin
arterial fetal, y finalmente alteracin del patrn de la frecuencia
cardaca. El tiempo estimado que puede transcurrir entre el aumento de
la resistencia del Doppler de la arteria umbilical a la aparicin de
desaceleraciones tardas es alrededor de 2 semanas. Sin embargo, este
tiempo estimado vara segn diversas caractersticas fetales y maternas,
entre ellas edad gestacional (ms rpidamente aparece el deterioro en
fetos de mayor edad gestacional) e hipertensin materna.
143
Las
desaceleraciones tardas en la monitorizacin cardaca fetal son
antecedidas por un periodo de 2 semanas de una vasodilatacin
extrema de la arteria cerebral media, y por unos pocos das de un
aumento abrupto de la resistencia de la arteria umbilical.
127
En la
primera parte de la adaptacin hemodinmica fetal a la hipoxia se
observa un aumento del volumen cardaco hacia el ventrculo izquierdo,
hecho que favorece la perfusin cerebral fetal.
144
Sin embargo,
paralelamente al deterioro de la condicin fetal se observa una
alteracin del dbito cardaco y un progresiva insuficiencia cardaca
fetal. La alteracin del flujo en el ductus venoso demuestra una
36
descompensacin hemodinmica fetal, caracterizada por un aumento del
ndice de pulsatilidad venoso y ausencia de la onda A (sstole auricular)
en su forma ms extrema. Estos cambios se manifiestan paralelamente
con los cambios en el patrn de la frecuencia cardaca fetal y en especial
con la variabilidad a corto plazo computacional.
5;124;145
Desafortunadamente, el momento de la interrupcin es dependiente
esencialmente de la edad gestacional, por su alta influencia en el
pronstico neonatal, y podemos as ver que en fetos de trmino rara vez
encontramos patrones con las caractersticas ominosas anteriormente
expuestas, mientras que en fetos prematuros extremos podemos
observar estos patrones incluso por semanas antes de la interrupcin.
129
Bilardo y col en un estudio multicntrico realizado en Europa en 70
fetos con RCF interrumpidos entre 26 y 33 semanas de gestacin,
evaluaron por medio de un anlisis multivariado la utilidad de la arteria
umbilical, ductus venoso y la variabilidad a corto plazo computacional en
la determinacin de mal pronstico perinatal (mortalidad perinatal,
hemorragia cerebral >grado II, o displasia broncopulmonar) de estos
embarazos.
146
El mal pronstico perinatal se observ en 27% de los
fetos estudiados y la presencia de un ductus venoso alterado se asoci
significativamente a esta condicin. Se observo adems, que el riesgo
de presentar un mal pronstico perinatal aumentaba 3 y 11 veces si el
IPV del DV era 2 desviaciones estndares (sd) por sobre la media 2 a 7
das antes del parto o 3 sd un da antes de la interrupcin,
respectivamente.
En cuanto a la determinacin del mejor momento de la interrupcin
del embarazo en fetos hipxicos, el trabajo conocido como GRIT
(Growth Restriction Interventional Trial)
147
determin que no existen
beneficios significativamente estadsticos a corto plazo entre la
interrupcin inmediata o diferida, basada en la monitorizacin con
arteria umbilical y registro de latidos cardio-fetales, si existe
incertidumbre sobre la mejor conducta. Posteriormente, se public el
seguimiento a 2 aos del mismo grupo de fetos hipxicos interrumpidos
inmediatamente o diferidos, mostrando que no existen evidencias
suficientes para justificar una interrupcin inmediata de la gestacin con
el objetivo de evitar un dao hipxico terminal. Esto basado en sus
resultados que muestran que la mortalidad y secuelas severas en forma
global fue similar en ambos grupos (19% vs 16% entre inmediatos y
diferidos, respectivamente). Sin embargo, la mayora de las diferencias
observadas se localizaron en el grupo intervenido inmediatamente antes
de las 31 semanas de gestacin (13% vs 5% en el grupo de las
interrupciones diferidas).
148
Por lo tanto, es necesario establecer por medio de una combinacin
ms sofisticada de parmetros, tales como el IPV/ausencia de onda A
37
del ductus venoso y la disminucin de la variabilidad a corto plazo
computacional (menor de 3 ms), el mejor momento de la interrupcin
de este tipo de gestaciones. Otro parmetro que es determinante en la
prediccin de riesgo en los fetos con RCF es la edad gestacional al
momento de la interrupcin, es as que en el estudio de Bilardo y col. se
observ una disminucin de 50% en el resultado perinatal adverso por
cada semana de retraso en la interrupcin de ste.
La nica forma de evaluar adecuadamente el dilema del mejor
momento de la interrupcin de los fetos con RCF, se determinar a
travs de un estudio multicntrico, randomizado de las distintas
alternativas de manejo. Este estudio est prcticamente en curso en la
actualidad y es liderado por el Profesor Christopher Lees de la
Universidad de Cambridge y se denomina TRUFFLE (TRial of Umbilical
and Fetal FLow in Europe).
38
III. UTILIDAD DEL DOPPLER EN EL DIAGNSTICO DE ANEMIA
FETAL ALOINMUNE
1. INTRODUCCION
El grado de severidad de la isoinmunizacin Rh varia desde un
recin nacido sano a la presencia de hidrops y muerte fetal in tero, tan
precoz como 17 semanas.
Sin tratamiento, 50% de los nios afectados no presentaran signos
o solo desarrollarn una anemia leve. Del 50% restante, la mitad
presentar una anemia y hepatoesplenomegalia moderada, adems de
ictericia. Este grupo requerir un recambio sanguneo dentro de las
primeras 24 hrs. de vida, de lo contrario desarrollarn kernicterus. El
25% restante de los nios afectados, desarrollarn hidrops y
usualmente fallecern in tero o en el perodo neonatal. El 50% de los
fetos hidrpicos desarrollar los signos de esta condicin entre las 18 y
30 semanas de gestacin
149
Los objetivos del tratamiento antenatal son:
- Predecir si el feto esta severamente afectado y en que edad
gestacional se presentar el hidrops o muerte fetal.
- Corregir la anemia fetal e interrumpir el embarazo en el
tiempo adecuado.
Existen alrededor de 100 diferentes antgenos en la superficie del
globulo rojo y el desarrollo de anticuerpos maternos en contra de
aproximadamente 30 de ellos podra llevar a una anemia hemoltica
fetal. Sin embargo, la gran mayora de los casos son por
incompatibilidad ABO o isoinmunizacin Rh.
2. ISOINMUNIZACION RH
2.1. Incidencia:
Aunque el tratamiento profilctico fue introducido en 1968,
aproximadamente 1:1000 recin nacidos presentan complicaciones de
enfermedad hemoltica.
150
En una publicacin norteamericana en el ao
2002 se inform una incidencia de 6,8 por 1000 recin nacidos.
151
2.2. Fisiopatologa:
Se postula que ha medida que progresa la edad gestacional
aumenta el volumen y frecuencia de paso de sangre fetal al torrente
sanguineo materno. Empleando la prueba de Kleihauer, Bowman y col.
39
149
observaron la presencia de 0,01 ml de glbulos rojos fetales en el
3%, 12% y 46% en los tres trimestres respectivamente. En la mayora
de los casos la carga antignica de los glbulos rojos fetales es
insuficiente para estimular la respuesta inmune materna. Sin embargo,
una hemorragia feto-materna mayor durante el embarazo o parto
establece una respuesta de los linfocitos B maternos. La respuesta
materna inicial a travs de IgM anti RhD es breve y con un rpida
transformacin a respuesta inmune a travs de IgG. La exposicin a
nuevos antgenos RhD durante el siguiente embarazo, activa la
memoria de los linfocitos B, los cuales proliferan rpidamente,
activando subsecuentemente la respuesta en base a IgG. La IgG
materna cruza la placenta y destruye los glbulos rojos fetales Rh
positivos, conduciendo al establecimiento de anemia fetal.
2.3. Fisiopatologa de la anemia fetal
Normalmente, en un embarazo normal la hemoglobina (Hb) fetal
aumenta desde 10 g/dl a las 16 semanas a 15 g/dl a las 40 semanas
(1sd=1,2g/dl)
37
Se define una anemia moderada como un dficit de 2-4 sd y anemia
severa como un dficit mayor de 4 sd. Cuando el dficit de Hb excede
las 5 sd se presenta hidrops. Concomitantemente con anemia severa se
presenta una eritroblastosis compensatoria. Debido a este ltimo
mecanismo compensatorio, a nivel heptico se produce hipertensin
portal y/o hipoproteinemia.
2.4. Prediccin de anemia fetal
La severidad de la hemlisis se puede predecir por:
152
- Historia previa de embarazo afectado
- Nivel de anticuerpos maternos
- Morfometra alterada del feto y placenta
- Monitorizacin cardaca fetal alterada
- Alteracin de flujometra Doppler fetal (arteria cerebral
media)
A. Antecedentes de embarazo previo afectado por
isoinmunizacin Rh
Si existe el antecedente de un mortinato previo, las probabilidades
de que sto se repita, sin que medie un tratamiento, es de un 90%. Se
ha estimado que luego de un mortinato ocasionado por una
40
isoinmunizacin Rh, existe un 50% de probabilidad de que se presente
nuevamente este evento antes de las 35 semanas de gestacin. Si
existe ms de un caso de mortinato, la posibilidad de que se presente
nuevamente es de un 50% antes de las 32 semanas de gestacin.
153;154
B. Aumento de anticuerpos maternos
Ttulos de Ac maternos, medidos a travs del test de Coombs
indirecto (Coombs, 1945), <1/32 reflejan una enfermedad hemoltica
leve. Ttulos >1/32 reflejan que la enfermedad podra ser severa (Allen,
1954). Nicolaides y cols.
155
demostraron que exista una relacin directa
entre la cantidad de anticuerpos maternos y el grado de anemia fetal. Si
la concetracin del Ac anti-D materno es <5UI/ml (<1/32) existe un
97% de probabilidades de que el feto no sea anmico. Niveles entre 5-
14 UI/ml (1/32-1/128) se asocian a anemia moderada. Por el contrario,
si la concentracin del Ac anti-D es mayor de 15UI/ml (1/128) se asocia
a un 15% de anemia y un 5% tendr un grado de severidad que
requerir transfusin intrauterina.
C. Morfometra feto-placentaria
Se ha tratado de encontrar elementos ecogrficos que aparezcan
antes de la manifestacin de ascitis e hidrops. Sin embargo ningn
elemento ecogrfico pre-hidrops ha demostrado ser til en la prediccin
de diversos grados de anemia.
37
D. Monitorizacin fetal
Estudios comparativos entre el grado de anemia fetal
(concentracin de Hb fetal) y distintos patrones de la frecuencia
cardiaca fetal en la monitorizacin han demostrado lo siguiente: anemia
severa esta comnmente relacionado con un patrn sinusoidal. A pesar
de que registros no reactivos o desaceleratorios son sugerentes de
anemia, la gran mayora de los fetos con anemia moderada no
presentan alteraciones en la monitorizacin.
152
E. Doppler
En la actualidad se est iniciando el uso de la arteria cerebral media
como elemento para determinar el grado de anemia fetal, tanto pre
como post cordocentesis. En trabajos realizados tanto por G. Mari como
por K.H. Nicolaides, han demostrado la gran utilidad de esta evaluacin
en el manejo se isoinmunizacin Rh.
41
El aumento de la velocidad mxima de la arteria cerebral media se
producira por una disminucin de la viscosidad de la sangre fetal
anmica que llevara a un aumento del retorno venoso y precarga, con
el consecuente aumento del dbito cardaco (flujo hiperdinmico). Esto
aumenta el flujo de la vena umbilical, vena cava inferior, aorta
descendente, cartida comn y cerebral media
156-158
.
Adems, la utilizacin de un examen de cribado es necesario debido
al hecho que el hidrops fetal se presenta slo cuando el dficit de
hemoglobina sobrepasa las 6 desviaciones estndares.
37
Un aumento de
la velocidad mxima de la arteria cerebral media (>1,5 sd, segn
Scheier,M. o 1,5 MoM, segn Mari,G.) tiene una capacidad de deteccin
de anemia severa que fluctua entre 96 o 100%, con una tasa de falsos
positivos de alrededor de 15%. Esto determina que empleando la arteria
cerebral media se puede reducir el empleo de la cordocentesis en
prcticamente un 80% de los embarazos con fetos isoinmunizados.
156;159
Localmente, nuestro grupo en colaboracin con el Hospital San
Borja Arriarn, public recientemente nuestros hallazgos en torno a la
utilidad del Doppler de arteria cerebral media, tanto en el diagnstico de
anemia como en el seguimiento post-transfusional en fetos anmicos
isoinmunes.
160
En este estudio encontramos una correlacin significativa
inversamente proporcional entre los MoM de la Hemoglobina fetal y la
velocidad mxima de la ACM, pre (r=0,62) y post-transfusional
(r=0,55).
Figura 18. Utilidad de la velocidad mxima de la arteria cerebral
media en el diagnstico y manejo de la anemia fetal isoinmune
42
RELACION MOM VM-ACM y MOM Hb fetal
PRETRANSFUSION
r=0.62 p<0,006
0.00
0.40
0.80
1.20
1.60
2.00
2.40
2.80
0.00 0.20 0.40 0.60 0.80 1.00
MOM Hb fetal
M
O
M
V
M
-
A
C
M
RELACION MOM VM-ACM y MOM Hb fetal
POSTTRANSFUSION
r = 0,55 p<0,05
0.00
0.40
0.80
1.20
1.60
2.00
0.60 0.70 0.80 0.90 1.00 1.10 1.20
MOM Hb fetal
M
O
M
V
M
-
A
C
M
43
Finalmente, el grupo del Kings College sugiere el siguiente
esquema de manejo de la isoinmunizacin Rh, basado esencialmente en
el antecedente de embarazo previo efectado, niveles de anticuerpos
maternos, signos ecogrficos de ascitis, y velocidad mxima de arteria
cerebral media
Figura 19. Esquema actualizado del manejo de isoinmunizacin Rh
44
IV. UTILIDAD DEL DOPPLER EN EL EMBARAZO GEMELAR
MONOCORIAL
I. INTRODUCCION
Los embarazos gemelares monocoriales con transfusin feto-fetal
severa que se presenta entre 15 y 25 semanas de gestacin tienen un
alto riesgo de aborto, muerte perinatal y mayor porcentaje de secuelas
neonatales que en los sobrevivientes.
161;162
1. DEFINICION Y ETIOPATOGENIA
La transfusin feto-fetal (TFF) ocurre solamente en los embarazos
gemelares monocoriales, en los cuales se presenta un desbalance en el
flujo neto a travs de la placenta debido a las anastomosis vasculares
que existe en esta condicin. La incidencia de la TFF es del 15%.
Schatz, 1875 describi por primera vez esta condicin. Las
comunicaciones pueden ser tanto veno-venosas y arterio-arteriales,
pero son las arterio-venosas las que llevan a las manifestaciones de la
TFF. La TFF se puede manifestar como una condicin leve, como severa,
dependiendo del grado de comunicacin que se establece entre las
anastomosis placentarias profundas arterio-venosas.
El mecanismo etiopatognico preciso del desarrollo de esta
condicin es an desconocido. Se piensa que un desarrollo defectuoso
de la placenta del feto donante podra ser la causa, lo cual producira un
aumento de la resistencia perifrica de esta placenta y traspaso de
sangre al feto receptor. Por lo tanto el feto donante sufre tanto de
hipovolemia como de hipoxia por insuficiencia placentaria.
163
En tanto
que el feto receptor presenta un crculo vicioso de hipervolemia, poliuria
e hiperosmolaridad que lleva a polihidroamnios e insuficiencia cardiaca.
2. DIAGNOSTICO
Clsicamente el diagnstico de TFF se realizaba retrospectivamente
en la etapa neonatal en base a la diferencia en peso de 20% o ms y en
la concentracin de hemoglobina de 5gr/dl. Sin embargo, la TFF severa,
que se presenta precozmente en el segundo trimestre, se realiza en
base a la presencia de polihidroamnios/anhidramnios, vejiga distendida
en el receptor y ausente en el donante, alteraciones de la flujometra
Doppler: flujo ausente en la arteria umbilical del donante y ausencia de
la onda A del ductus venoso en el receptor.
164
45
Otros signos importantes son la presencia de un corazn
hipertrfico, dilatado y disquintico en el receptor. En el donante, por
otro lado, se observa un corazn dilatado e intestinos hiperecognicos.
3. PESQUISA DE LA TFF
Aunque los signos clnicos de la TFF se presentan a inicios del
segundo trimestre, la alteracin fisiopatolgica comienza precozmente
en el embarazo. En un estudio con 485 embarazos gemelares entre las
10-14 semanas, se encontr que la tasa de aborto y mortinato en el
embarazo bicorinico fu del 2% y 1%, respectivamente. Por otro lado,
en el embarazo monocorial las tasas fueron 12% y 2%,
respectivamente. Se atribuy que la alta tasa de aborto en el embarazo
gemelar monorial se debera a la TFF.
165
Signos precoces de transfusin feto-fetal severa son discrepancia en
la LCN y translucidez nucal entre 11-14 semanas y plegamiento de la
membrana amnitica a las 16 semanas.
166;167
4. TRATAMIENTO DE ELECCIN: COAGULACION LASER DE
LOS VASOS COMUNICANTES PLACENTARIOS
Los vasos comunicantes, especialmente las comunicaciones arterio-
venosas, se encuentran localizadas profundamente en los cotiledones
placentarios, sin embargo los aferentes y eferentes circulan en la
superficie de la placenta. Recientemente, Senat y cols.
168
informaron
con 140 fetos randomizados a tratamiento Lser de los vasos
comunicantes o amniodrenaje, que la primera es superior a la segunda,
tanto en el nmero de fetos sobrevivientes (76 vs 56%, p<0,009), como
en la prevalencia de leucomalacia periventricular qustica neonatal (6 vs
14%, p<0,02) y porcentaje de dao neurolgico global (48 vs 69%,
p<0,003).
5. UTILIDAD DEL DOPPLER EN EL EMBARAZO GEMELAR
MONOCORIAL
A. Vasos arteriales fetales
Como se dijo anteriormente, el Doppler es til tanto en el
diagnstico, clasificacin y manejo de la TFF. Hecher y cols investigaron
el patrn circulatorio del feto donante y receptor en embarazos con
TFF.
164
Se observ un aumento del IP de la arteria umbilical y
disminucin de la velocidad promedio de la aorta torxico en ambos
gemelos, una disminucin del IP de la arteria cerebral media en el
receptor y disminucin de la velocidad promedio en el donante. El
46
aumento del IP de la arteria umbilical tanto en el receptor como en el
donante pueden ser reflejo del aumento de la presin intraamnitica y
de la resistencia placentaria, respectivamente. Estos hallazgos son
compatibles con hipovolemia y anemia en el donante e hipervolemia con
insuficiencia cardaca en el receptor.
B. Vasos venosos
En un estudio realizado en embarazos gemelares con TFF para
determinar el patrn circulatorio del donante y receptor, Hecher y cols
164
determin que exista un aumento de los ndices de pulsatilidad
venoso en ambos gemelos. El gemelo donante se caracterizaba por un
aumento del IPV del ductus venoso secundario a hipovolemia, con la
consecuente disminucin de la precarga, y aumento de la postcarga
debido al aumento de la resistencia placentaria. Mientras que el gemelo
receptor muestra evidencias de flujo hiperdinmico, caracterizado por
un aumento del IPV del ductus venoso. (Figura)
Figura 20. Patrn del Doppler de arteria umbilical y ductus venoso
en los gemelos donante y receptor, respectivamente.
F Fl lu uj jo o A Au us se en nt te e / / R Re ev ve er rs so o e en n A Ar rt te er ri ia a u um mb bi il li ic ca al l d do on na an nt te e
O On nd da a a a A Au us se en nt te e / / R Re ev ve er rs so o e en n
D Du uc ct tu us s v ve en no os so o d de el l r re ec ce ep pt to or r
47
V. DOPPLER Y ANEUPLOIDIA
Ductus venoso
El ductus venoso es una comunicacin nica que dirige la sangre
oxigenada desde la vena umbilical directamente hacia la circulacin
cerebral y coronaria, la cual es dirigida por un flujo preferencial de alta
velocidad que lo lleva a travs del foramen oval y aurcula izquierda. El
flujo del ductus venoso, a diferencia de otros flujos venosos, se
caracteriza por tener simpre flujos anterogrados, incluso durante la
contraccin auricular (onda A). La alteracin del ductus venoso,
caracterizada por un aumento del ndice de pulsatilidad venoso (IPV) o
ausencia de onda A, se observa habitualmente en el segundo y tercer
trimestre secundario a una descompensacin cardaca (insuficiencia
cardaca) de una hipoxia fetal.
164
Por otro lado, la alteracin del ductus venoso en el primer trimestre
(ver figura con imagen normal de onda del ductus venoso) se ha
asociado a alteraciones cromosmicas, defectos cardacos, y mal
resultado perinatal. En un meta-anlisis de 6 estudios en fetos con
ductus venoso anormal, se encontr una asociacin de 83% con
Sndrome de Down y 74% con otras alteraciones cromosmicas con 5%
de falsos positivos.
169
En este meta-anlisis se inform que en los
distintos estudios se encontr ya sea una ausencia o una debil
asociacin con aumento de la translucidez nucal. Nuestro grupo
present recientemente en el Congreso Mundial de Obstetricia y
Ginecologa nuestra experiencia con alrededor de 200 mediciones entre
11-14 semanas de gestacin.
170
En este estudio mostramos un relacin
directamente proporcional con el aumento de la translucidez nucal
(r=0,72,p<0,001) y consecuentemente su asociacin con mal pronstico
perinatal (60% de malformaciones cardacas, siendo la mayora asociada
a aumento de TN y aneuploida) (Figura y Tabla).
48
Figura 21. Doppler color de ductus venoso entre 11-14 semanas
de gestacin.
Figura 22. Correlacin entre IPV ductus venoso y translucidez
nucal a las 11-14 semanas de gestacin.
r = 0,72 p<0,001
0
0.5
1
1.5
2
2.5
3
3.5
4
4.5
0 5 10 15 20 25
TN (mm)
I
P
V
D
V
Tabla III. Mal pronstico perinatal asociado a la presencia de IPV
ductus venoso sobre el percentil 95 entre 11-14 semanas.
Patologa IPV TN
(mm)
MF
cardaca
Sd Apert 2,48 13 CIV
Sd
Edwards
2,17 13 Ventrculo
nico
RCF 2,02 1,4 No
49
Sd Down 1,88 4,0 Canal AV
Aborto
(15 sem)
1,61 7,2 ?
Otros estudios tambin han mostrado resultados contradictorios,
Bilardo y col
171
mostraron que el flujo del ductus venoso estaba alterado
en 80% de los fetos con mal pronstico perinatal, pero tambin en 17%
de los fetos normales. Comas y col., por otro lado seal en su estudio
que el ductus venoso es una excelente herramienta para la prediccin
de aneuploida (ductus venoso anormal, definido como IPV sobre el
percentil 97,5, visible en 82% de Sd. Down y slo en 4,4% de los
normales).
Por lo tanto, la recomendacin actual sobre el uso del ductus
venoso en el cribado de aneuploida y malformaciones cardacas en
pacientes de la poblacin general es de mucha precaucin, pues en
primer lugar, la tcnica debe ser realizada con extremado cuidado,
debido a la contaminacin con vasos cercanos, lo cual puede
errneamente plantear una alteracin en este flujo (aumento falsos
positivos) y conducir a procedimientos invasivos innecesarios. En
segundo lugar, existen evidencias en ciertos estudios que habra una
asociacin estadsticamente significativa entre la translucidez nucal y el
flujo en el ductus venoso, hecho que invalidara su uso como marcador
independiente de aneuploida y cardiopata.
Finalmente, se puede plantear que se recomienda su uso solo en
casos donde existe una TN aumentada, asumiendo independencia
estadstica, y se requiere evaluar la necesidad de un procedimiento
invasivo, debido a su capacidad de redirlos (1% de falsos positivos).
Arteria uterinas
La invasin del trofoblasto extravellositario hacia las arterias
espiraladas se inicia alrededor de las 12 semanas de gestacin, producto
de un cambio de la presin parcial de oxgeno en el espacio
intervelloso.
171
La alteracin de este fenmeno fisiolgico, expresado a
travs del aumento del ndice de pulsatilidad de las arteria uterinas, se
ha asociado en el segundo y tercer trimestre con la aparicin de pre-
eclampsia y restriccin de crecimiento fetal.
172;173
En un estudio realizado en un grupo de mujeres embarazadas con
Doppler de arteria uterina realizado entre 11-14 semanas de gestacin,
se encontr que no haba diferencias significativas entre fetos con
aneuploida y sus controles.
174
Estos autores concluyeron que la alta
50
letalidad intrauterina de los casos de alteraciones cromosmicas,
especialmente aquellos asociados a restriccin de crecimiento fetal como
la trisoma 18 y triploida, no se asocian a alteraciones en la
placentacin precoz y por lo tanto no seran tiles para su deteccin.
Arteria umbilical
Existen evidencias contradictorias de la asociacin entre el aumento
de la impedancia de la arteria umbilical en el primer trimestre y
alteraciones cromosmicas. Uno de estos estudios mostr en el grupo
con arteria umbilical sobre el percentil 95 un 55% de fetos/neonatos con
alteraciones cromosmicas, mientras que otros dos estudios no
mostraron diferencias significativas con los controles normales, slo 7%
de fetos con alteraciones cromosmicas en el grupo con arteria umbilical
alterada.
175,176
Otro estudio, mostr que la ausencia o flujo reverso en distole de
la arteria umbilical entre 11-14 semanas se asoci con un 80% de
aneuploida, pero todos ellos tenan tambin un aumento de la
translucidez nucal.
177
Estos antecedentes ayudan a sealar que la
arteria umbilical no es un buen examen de cribado de aneuploidas.
Vena Umbilical
Las pulsaciones venosas en el segundo y tercer trimestre del
embarazo son un signo ominoso de compromiso fetal.
178
En un estudio
realizado en el primer trimestre mostr en primer lugar que un 25% de
los fetos normales presentan pulsaciones en la vena umbilical y en el
90% de los fetos con sndrome de Edwards o Pateau. Sin embargo, en
los fetos con sndrome de Down no hubo diferencias significativas con
los controles.
179
51
Reference List
1. Albaiges G, Missfelder-Lobos H, Lees C, Parra M, Nicolaides KH. One-stage
screening for pregnancy complications by color Doppler assessment of the uterine
arteries at 23 weeks' gestation. Obstet.Gynecol. 2000;96:559-64.
2. Papageorghiou AT, Yu CK, Bindra R, Pandis G, Nicolaides KH. Multicenter
screening for pre-eclampsia and fetal growth restriction by transvaginal uterine
artery Doppler at 23 weeks of gestation. Ultrasound Obstet.Gynecol. 2001;18:441-
49.
3. Martin AM, Bindra R, Curcio P, Cicero S, Nicolaides KH. Screening for pre-
eclampsia and fetal growth restriction by uterine artery Doppler at 11-14 weeks of
gestation. Ultrasound Obstet.Gynecol. 2001;18:583-86.
4. Parra M, Rodrigo R, Fernandez V, Bosco C, Soto-Chacn E, Munoz H et al.
Screening test for preeclampsia through assessment of uteroplacental blood
flow and biochemical markers of oxidative stress and endothelial dysfunction.
American Journal of Obstetrics and Gynecology 2005;in press.
5. Hecher K, Bilardo CM, Stigter RH. Monitoring of fetuses with intrauterine growth
restriction: a longitudinal study. Ultrasound In Obstetrics & Gynecology
2001;18:564-70.
6. Baschat AA. Pathophysiology of fetal growth restriction: Implications for diagnosis
and surveillance. Obstetrical & Gynecological Survey 2004;59:617-27.
7. Lees C, Dean CA, Albaiges G. Making Sense of Obstetric Doppler Ultrasound.
London: Arnold, Hodder Headline Group, 2003.
8. Parra M, Lees C, Missfelder-Lobos H, Seed PT, Harris C, Nicolaides KH. Fetal
arterial and venous Doppler pulsatility index and time averaged reference
ranges for a high risk population. Ultrasound in Obstetrics & Gynecology 2005;in
press.
9. Chang TC, Robson SC, Boys RJ, Spencer JA. Prediction of the small for gestational
age infant:which ultrasonic measurement is best? Obstet.Gynecol. 1992;80:1030-38.
10. Wilcox AJ. Intrauterine growth retardation:beyond birthweight criteria. Early
Hum.Dev. 1983;8:189-93.
11. Chard T, Costeloe K, Leaf A. Evidence of growth retardation in neonates of
apparently normal weight. Eur.J.Obstet.Gynecol.Reprod.Biol 1992;45:59-62.
12. McIntire DD, Bloom SL, Casey BM, Leveno KJ. Birthweight in relation to
morbidity and mortality among newborn infants. N.Engl.J.Med. 1999;340:1234-38.
52
13. Kok JH, denOuden AL, VerlooveVanhorick SP, Brand R. Outcome of very preterm
small for gestational age infants: the first nine years of life. British Journal Of
Obstetrics And Gynaecology 1998;105:162-68.
14. Barker DJ, Gluckman PD, Godfrey KM, Harding JE, Owens JA, Robinson JS. Fetal
nutrition and cardiovascular disease in adult life. Lancet 1993;341:938-41.
15. Gardosi J, Mul T, Mongelli M, Fagan D. Analysis of birthweight and gestational
age in antepartum stillbirths. Br.J.Obstet.Gynaecol. 1998;105:524-30.
16. Lewis G et al. Why mother die: Report on Confidential Enquiries into Maternal
Deaths in the United Kingdom 1994-1996. Department of Health, Welsh Office
Scotish Office Department of Health and Department of Health and Social Services.
London. 1998.
Ref Type: Report
17. Valdes G, Oyarzun E. Sndromes hipertensivos del embarazo. In: Eds A Prez y E
Donoso, editor. Obstetricia. Santiago, Chile: Publicaciones Tcnicas Mediterrneo;
1999. p. 52.
18. Meis PJ, Goldenberg RL, Mercer BM, Iams JD, Moawad AH, Miodovnik M. The
preterm prediction study: risk factors for indicated preterm births.
Am.J.Obstet.Gynecol. 1998;178:562-67.
19. Sibai BM. Prevention of preeclampsia: a big disappointment. Am.J.Obstet.Gynecol.
1998;179:1275-78.
20. Arngrimsson R, Bjornsson S, Geirsson RT, Bjornsson H, Walker JJ, Snaedal G.
Genetic and familial predisposition to eclampsia and pre-eclampsia in a defined
population. Br.J.Obstet.Gynaecol. 1990;97:762-69.
21. Robillard PY, Hulsey TC, Perianin J, Janky E, Miri EH, Papiernik E. Association of
pregnancy-induced hypertension with duration of sexual cohabitation before
conception. Lancet 1994;344:973-75.
22. Redman CW, Sacks GP, Sargent IL. Pre-eclampsia, an excessive maternal
inflammatory response to pregnancy. Am.J.Obstet.Gynecol. 1999;180:499-506.
23. Holland E. Recent work on the aetiology of eclampsia. J.Obstet.Gynecol.Br.Emp
1909;16:255-73.
24. Page EW. The relation between hydatid moles, relative ischaemia of the gravid
uterus, and the placental origin of eclampsia. Am.J.Obstet.Gynecol. 1939;37:291-
93.
25. Rauramo I, Forss M. Effect of exercise on placental blood flow in pregnancies
complicated by hypertension, diabetes or intrahepatic cholestatasis. Acta
Obstet.Gynecol.Scand. 1988;67:15-20.
53
26. Brosens I, Robertson WB, Dixon HG. The role of the spiral arteries in the
pathogenesis of pre-eclampsia. Obstet.Gynecol.Annu. 1972;1:171-91.
27. Khong TY, De Wolf F, Brosens I. Inadequate material vascular response to
placentation in pregnancies complicated by pre-eclampsia and by small-for-
gestational age infants. British Journal Of Obstetrics And Gynaecology
1986;93:1049-59.
28. Genbacev O, Zhou Y, Ludlow JW, Fisher SJ. Regulation of human placental
development by oxygen tension. Science 1997;277:1669-72.
29. Caniggia I, Winter J, Lye SJ, Post M. Oxygen and placental development during the
first trimester: implications for the pathophysiology of pre-eclampsia. Placenta
2000;21 Suppl A:S25-S30.
30. King A, Hiby SE, Gardner L, Joseph S, Bowen JM, Verma S et al. Recognition of
trophoblast HLA class I molecules by decidual NK cell receptors-a review. Placenta
2000;21:S81-S85.
31. Caniggia I, Mostachfi H, Winter J, Gassmann M, Lye SJ, Kuliszewski M et al.
Hypoxia-inducible factor-1 mediates the biological effects of oxygen on human
trophoblast differentiation through TGFbeta(3). J.Clin.Invest 2000;105:577-87.
32. Rajakumar A, Whitelock KA, Weissfeld LA, Daftary AR, Markovic N, Conrad KP.
Selective overexpression of the hypoxia-inducible transcription factor, HIF-2alpha,
in placentas from women with preeclampsia. Biol Reprod. 2001;64:499-506.
33. Ahmed A, Dunk C, Ahmad S, Khaliq A. Regulation of placental vascular
endothelial growth factor (VEGF) and placental growth factor (PlGF) and soluble
Flt-1 by oxygen-A review. Placenta 2000;14:S16-S24.
34. Tidwell SC, Ho HN, Chiu WH, Torry RJ, Torry DS. Low maternal serum levels of
placental growth as an antecedent of clinical preeclampsia. Am.J.Obstet.Gynecol.
2001;184:1267-72.
35. Maynard SE, Min JJ, Merchan J, Lim K, Li J, Mondal S et al. Excess placental
soluble fms-like tyrosine kinase 1 (sFlt1) may contribute to endothelial dysfunction,
hypertension, and proteinuria in preeclampsia. J.Clin.Invest 2003;111:649-58.
36. Lyall F, Bulmer JN, Kelly H, Duffie E, Robson SC. Human trophoblast invasion
and spiral artery transformation: the role of nitric oxide. American Journal of
Pathology 1999;154:1105-14.
37. Nicolaides KH, Bilardo CM, Soothill PW, Campbell S. Absence of end diastolic
frequencies in the umbilical artery: a sign of fetal hypoxia and acidosis. Brit.Med.J.
1988;297:1026-27.
54
38. Soothill PW, Nicolaides KH, Bilardo CM, Hackett G, Campbell S. Utero-placental
blood flow velocity resistance index and venous pO2, pCO2, pH, lactate and
erythroblast count in growth retarded fetuses. Fetal Ther 1986;1:176-79.
39. Brosens I, Robertson WB, Dixon HG. The role of the spiral arteries in the
pathogenesis of pre-eclampsia. Obstet.Gynecol Annu 1972;1:177-91.
40. Giles WB, Trudinger BJ, Baird PJ. Fetal umbilical artery flow velocity waveforms
and placental resistance:pathological correlation. Br.J.Obstet.Gynaecol. 1985;92:31-
38.
41. Meekins JW, Pijnenborg R, Hanssens M, McFadyen IR, van Asshe A. A study of
placental bed spiral arteries and trophoblast invasion in normal and severe pre-
eclamptic pregnancies. Br.J.Obstet.Gynaecol. 1994;101:669-74.
42. Roberts JM, Redman CW. Pre-eclampsia: more than pregnancy-induced
hypertension. Lancet 1993;341:1447-51.
43. Caritis S, Sibai B, Hauth J, Lindheimer M, VanDorsten P, Klebanoff M et al.
Predictors of pre-eclampsia in women at high risk. National Institute of Child
Health and Human Development Network of Maternal-Fetal Medicine Units.
Am.J.Obstet.Gynecol. 1998;179:946-51.
44. Lie, R. T., Rasmussen, S., Brunborg, H., Gjessing, H. K., Lie-Nielsen, E., and
Ingens, L. M. fetal and maternal contributions to risk of pre-eclampsia: population
based study. BMJ 316, 1343-1347. 1998.
Ref Type: Abstract
45. Roberts JM, Taylor RN, Musci TJ, Rodgers GM, Hubel CA, McLaughlin MK.
Preeclampsia: an endothelial cell disorder [see comments]. Am.J.Obstet.Gynecol.
1989;161:1200-04.
46. Cadroy Y, Grandjean H, Pichon J, Desprats R, Berrebi A, Fournie A et al.
Evaluation of six markers of haemostatic system in normal pregnancy and
pregnancy complicated by hypertension or pre-eclampsia. Br.J.Obstet.Gynaecol.
1993;100:416-20.
47. Halligan A, Bonnar J, Sheppard B, Darling M, Walshe J. Haemostatic, fibrinolytic
and endothelial variables in normal pregnancies and pre-eclampsia.
Br.J.Obstet.Gynaecol. 1994;101:488-92.
48. Chappell LC, Seed PT, Briley AL, Kelly FJ, Lee R, Hunt BJ et al. Effect of
antioxidants on the occurrence of pre-eclampsia in women at increased risk: a
randomised trial. Lancet 1999;354:810-16.
49. Reith A, Booth NA, Moore NR, Cruickshank DJ, Bennett B. Plasminogen activator
inhibitors (PAI-1 and PAI-2) in normal pregnancies, pre-eclampsia and
hydatidiform mole. Br.J.Obstet.Gynaecol. 1993;100:370-74.
55
50. Cockell AP, Poston L. Flow-mediated vasodilatation is enhanced in normal
pregnancy but reduced in preeclampsia [see comments]. Hypertension 1997;30:247-
51.
51. Savvidou MD, Hingorani AD, Tsikas D, Frolich JC, Vallance P, Nicolaides KH.
Endothelial dysfunction and raised plasma concentrations of asymmetric
dimethylarginine in pregnant women who subsequently develop pre-eclampsia.
Lancet 2003;361:1511-17.
52. Murray-Rust J, Leiper J, McAlister M. Structural insights into the hydrolisis of
cellular nitric oxide synthase inhibitors by dimethylarginine
dimethylaminohydrolase. Nat Struct Biol 2001;8:679-83.
53. McCarthy AL, Woolfson RG, Raju SK, Poston L. Abnormal endothelial cell
function of resistance arteries from women with preeclampsia.
Am.J.Obstet.Gynecol. 1993;168:1323-30.
54. Knock GA, Poston L. Bradykinin-mediated relaxation of isolated maternal
resistance arteries in normal pregnancy and preeclampsia. Am.J.Obstet.Gynecol.
1996;175:1668-74.
55. Pascoal IF, Lindheimer MD, Nalbantian-Brandt C, Umans JG. Preeclampsia
selectively impairs endothelium-dependent relaxation and leads to oscillatory
activity in small omental arteries. J.Clin.Invest 1998;101:464-70.
56. Kublickiene KR, Kublickas M, Lindblom B, Lunell NO, Nisell H. A comparison of
myogenic and endothelial properties of myometrial and omental resistance vessels
in late pregnancy. Am.J.Obstet.Gynecol. 1997;176:560-66.
57. Blundell G, Jones BG, Rose PA, Tundball N. Homocysteine mediated endothelial
cell toxicity and its amelioration. Atherosclerosis 1996;122:163-72.
58. Wang J, Dudman NP, Wilcken DE. Effects of homocysteine and related compounds
on prostacyclin production by cultured human vascular endothelial cells. Thromb
Haemost 1993;70:1047-52.
59. Freyburger G, Labrouche S, Sassoust G, Rouanet F, Javorschi S, Parrot F. Mild
hyperomocysteinemia and hemostatic factor in patients with arterial vascular
diseases. Thromb Haemost 1997;77:466-71.
60. Powers RW, Evans RW, Majors AK, Ojimba JI, Ness RB, Crombleholme WR et al.
Plasma homocysteine concentration is increased in preeclampsia and is associated
with evidence of endothelial activation. Am.J.Obstet.Gynecol. 1998;179:1605-11.
61. de Vries JI, Dekker GA, Huijgens PC, Jakobs C, Blomberg BM, van Geijn et al.
Hyperhomocysteinaemia and protein S deficiency in complicated pregnancies.
British Journal of Obstetrics & Gynaecology 1997;104:1248-54.
56
62. Ray JG, Laskin CA. Folic acid and homocysteine metabolic defects and the risk of
placental abruption, pre-eclampsia and spontaneous pregnancy loss: a systematic
review. Placenta 1999;20:519-29.
63. Cotter AM, Molloy AM, Scott JM, Daly SF. Elevated plasma homocysteine in early
pregnancy. A risk factor for the development of severe preeclampsia.
Am.J.Obstet.Gynecol. 2001;185:781-85.
64. DAnna R, Baviera G, Corrado F, Ientile R, Granese D, Stella NC. Plasma
homocysteine in early and late pregnancies complicated with preeclampsia and
isolated intrauterine growth restriction. Acta Obstet.Gynecol.Scand. 2004;83:155-
58.
65. Davidge ST. Oxidative stress and altered endothelial cell function in preeclampsia.
Semin.Reprod.Endocrinol. 1998;16:65-73.
66. Hubel CA, Kozlov AV, Kagan VE, Evans RW, Davidge ST, McLaughlin MK et al.
Decreased transferrin and increased transferrin saturation in sera of women with
preeclampsia: implications for oxidative stress. Am.J.Obstet.Gynecol.
1996;175:692-700.
67. Barden A, Beilin LJ, Ritchie J, Croft KD, Walters BN, Michael CA. Plasma and
urinary 8-iso-prostane as an indicator of lipid peroxidation in pre-eclampsia and
normal pregnancy. Clin.Sci.(Colch.) 1996;91:711-18.
68. Mikhail MS, Anyaegbunam A, Garfinkel D, Palan PR, Basu J, Romney SL.
Preeclampsia and antioxidant nutrients: decreased plasma levels of reduced ascorbic
acid, alpha-tocopherol, and beta-carotene in women with preeclampsia.
Am.J.Obstet.Gynecol. 1994;171:150-57.
69. Wang Y, Walsh SW. TNF alpha concentrations and mRNA expression are
increased in preeclamptic placentas. J.Reprod.Immunol. 1996;32:157-69.
70. Potter JM, Nestel PJ. The hyperlipidemia of pregnancy in normal and complicated
pregnancies. Am.J.Obstet.Gynecol. 1979;133:165-70.
71. Hubel CA, Roberts JM, Taylor RN, Musci TJ, Rogers GM, McLaughlin MK. Lipid
peroxidation in pregnancy: new perspectives on preeclampsia.
Am.J.Obstet.Gynecol. 1989;161:1025-34.
72. Hubel, C. A., Evans, R. W., and et al. J.Soc.Gyn.Invest 3(2), 314A. 1996.
Ref Type: Abstract
73. Morrow JD, Hill KE, Burk RF, Nammour TM, Badr KF, Roberts LJ. A series of
prostaglandin F2-like compounds are produced in vivo in humans by a non-
cyclooxygenase, free radical-catalyzed mechanism. Proc.Natl.Acad.Sci.U.S.A
1990;87:9383-87.
57
74. Walsh SW, Vaughan JE, Wang Y, Roberts LJ. Placental isoprostane is significantly
increased in preeclampsia. FASEB J. 2000;14:1289-96.
75. Reilly M, Delanty N, Lawson JA, FitzGerald GA. Modulation of oxidant stress in
vivo in chronic cigarette smokers. Circulation 1996;94:19-25.
76. Hubel CA, Kozlov AV, Kagan VE, Evans RW, Davidge ST, McLaughlin MK et al.
Decreased transferrin and increased transferrin saturation in sera of women with
preeclampsia: implications for oxidative stress. Am.J.Obstet.Gynecol.
1996;175:692-700.
77. Wang YP, Walsh SW, Guo JD, Zhang JY. The imbalance between thromboxane
and prostacyclin in preeclampsia is associated with an imbalance between lipid
peroxides and vitamin E in maternal blood. Am.J.Obstet.Gynecol. 1991;165:1695-
700.
78. Mikhail MS, Basu J, Palan PR, Furgiuele J, Romney SL, Anyaegbunam A. Lipid
profile in women with preeclampsia: relationship between plasma triglyceride levels
and severity of preeclampsia. J.Assoc.Acad.Minor.Phys. 1995;6:43-45.
79. Walsh SW, Wang Y. Secretion of lipid peroxides by the human placenta.
Am.J.Obstet.Gynecol. 1993;169:1462-66.
80. Poranen AK, Ekblad U, Uotila P, Ahotupa M. Lipid peroxidation and antioxidants
in normal and pre-eclamptic pregnancies. Placenta 1996;17:401-05.
81. Moretti M, Phillips M, Abouzeid A, Cataneo R, Greenberg J. Increased breath
markers of oxidative stress in normal pregnancy and in preeclampsia.
Am.J.Obstet.Gynecol. 2004;190:1184-90.
82. Stepan H, Heihoff-Klose A, Faber R. Reduced antioxidant capacity in second-
trimester pregnancies with pathological uterine prefusion. Ultrasound
Obstet.Gynecol. 2004;23:579-83.
83. Halaas JL, Gajiwata KS, Maffei M. Weight-reducing effects of the plasma protein
encoded by the obese gene. Science 1995;269:543-46.
84. Masuzaki H, Ogawa Y, Sagawa N. Nonadipose tissue production of leptin:leptin as
a novel placenta-derived hormone in humans. Nature 1997;382:250-52.
85. Solomon CG, Seely EW. Hypertension in pregnancy: a manifestation of the insulin
resistance syndrome? Hypertension 2001;37:232-39.
86. Mise H, Sagawa N, Matsumoto T, Yura S, Nanno H, Itoh H et al. Augmented
placental production of leptin in preeclampsia: possible involvement of placental
hypoxia. Journal of Clinical Endocrinology & Metabolism 1998;83:3225-29.
58
87. Grosfeld A, Andr J, Hauguel-de Mounzon S, Berra E, Pouyssegur J, Guerre-Millo
M. Hypoxia-inducible factor 1 transactivates the human leptin gene promoter. The
Journal of Biological Chemistry 2002;277:42953-57.
88. Sierra-Honigmann MR, Nath AK, Murakami C, Garcia-Cardena G,
Papapetropoulos A, Sessa WC. Biological action of leptin as an angiogenic factor.
Science 1998;281:1683-86.
89. Kimura K, Tsuda K, Baba A. Involvement of nitric oxide in endothelium-dependent
arterial relaxation by leptin. Biochem Biophys Res Commun 2000;273:745-49.
90. Yamagishi S, Edelstein D, Du X, Kaneda Y, Brownlee M. Leptin induces
mitochondrial superoxide production and monocyte chemoattractant protein-1
expression in aortic endothelial cells by increasing fatty acid oxidation via protein
kinase A. J.Biol Chem 2001;276:25096-100.
91. Poston L, Chappell LC. Is oxidative stress involved in the aetiology of pre-
eclampsia? Acta Paediatr.Suppl 2001;90:3-5.
92. Linnemann K, Malek A, Schneider H, Fusch C. Physiological and pathological
regulation of feto/placento/maternal leptin expression. Biochem Soc Trans
2001;29:86-90.
93. Morbidelli L. Nitric oxide mediates mitogenic effect of VEGF on coronary venular
endothelium. Am.J.Physiol 1996;270:H411-H415.
94. He H. Vascular endothelial growth factor signals endothelial cell production of
nitric oxide and prostacyclin through flk-1/KDR activation of c-Src. J.Biol.Chem
1999;274:25130-35.
95. Kendall RL, Wang G, Thomas KA. Identification of a natural soluble form of the
vascular endothelial growth factor receptor, FLT-1, and its heterodimerization with
KDR. Biophys.Res.Commun 1996;226:324-28.
96. Ostendorf T. VEGF(165) mediates glomerular endothelial repair. J.Clin.Invest
1999;104:913-23.
97. Yang, J. C. A randomized double-blind placebo controlled trial of bevacizumab
(anti-VEGF antibody) demonstrating a prolongation in time to progression in
patients with metastatic renal cancer: ASCO meeting abstract.
Proc.Am.Soc.Clin.Oncol 21, A15. 2002.
Ref Type: Abstract
98. Levine RJ, Maynard SE, Quian C, Lim K, England L, Yu KF et al. Circulating
angiogenic factors and the risk of preeclampsia. N.Engl.J.Med. 2004;350:672-83.
59
99. Ong CY, Liao AW, Cacho AM, Spencer K, Nicolaides KH. First-trimester maternal
serum levels of placenta growth factor as predictor of preeclampsia and fetal growth
restriction. Obstet.Gynecol. 2001;98:608-11.
100. Satu H, Piia V, Olli C, Carsten H, Herbert W, Erja H. Expression of vascular
endothelial growth factor receptors 1,2 and 3 in placentas from
normal and complicated pregnancies. Molecular Human Reproduction
2001;7:205-10.
101. Dekker G, Sibai B. Primary, secondary, and tertiary prevention of pre-eclampsia.
Lancet 2001;357:209-15.
102. Villar MA, Sibai BM. Clinical significance of elevated mean arterial blood pressure
in second trimester and threshold increase in systolic or diastolic blood pressure
during third trimester. Am.J.Obstet.Gynecol. 1989;160:419-23.
103. Conde-Agudelo A, Belizan JM. Risk factors for pre-eclampsia in a large cohort of
Latin American and Caribbean women. BJOG. 2000;107:75-83.
104. Dekker GA, Sibai BM. Early detection of preeclampsia. Am.J.Obstet.Gynecol.
1991;165:160-72.
105. Masse J, Forest JC, Moutquin JM, Marcoux S, Brideau NA, Belanger M. A
prospective study of several potential biologic markers for early prediction of the
development of preeclampsia. Am.J.Obstet.Gynecol. 1993;169:501-08.
106. Roberts JM, Lain KY. Recent insights into the pathogenesis of pre-eclampsia.
Placenta 2002;23:359-72.
107. Lala PK, Chakraborty C. Factors regulating trophoblast migration and invasiveness:
possible dearangements contributing to pre-eclampsia and fetal injury. Placenta
2003;24:575-87.
108. Chappell LC, Seed PT, Briley A, Kelly FJ, Hunt BJ, Charnock-Jones DS et al. A
longitudinal study of biochemical variables in women at risk of preeclampsia.
Am.J.Obstet.Gynecol. 2002;187:127-36.
109. Clausen T, Djurovic S, Brosstad FR, Berg K, Henriksen T. Altered circulating
levels of adhesion molecules at 18 weeks gestation among women with eventual
preeclampsia: indicators of disturbed placentation in absence of evidence of
endothelial dysfunction? Am.J.Obstet.Gynecol. 2000;182:321-25.
110. Aquilina J, Barnett A, Thompson O, Harrington K. Second-trimester maternal
serum inhibin A concentration as an early marker for preeclampsia.
Am.J.Obstet.Gynecol. 1999;181:131-36.
111. Roberts JM, Hubel CA. Is oxidative stress the link in the two-stage model of pre-
eclampsia? Lancet 1999;354:788-89.
60
112. Khong TY, De Wolf F, Robertson WB, Brosens I. Inadequate maternal vascular
response to placentation in pregnancies complicated by pre-eclampsia and by small-
for-gestational age infants. Br.J.Obstet.Gynaecol. 1986;93:1049-59.
113. Campbell S, Pearce JM, Hackett G, Cohen-Overbeek T, Hernandez C. Qualitative
assessment of uteroplacental blood flow: early screening test for high-risk
pregnancies. Obstet.Gynecol. 1986;68:649-53.
114. Steel SA, Pearce JM, McParland P, Chamberlain GV. Early Doppler ultrasound
screening in prediction of hypertensive disorders of pregnancy. Lancet
1990;335:1548-51.
115. Bewley S, Cooper D, Campbell S. Doppler investigation of uteroplacental blood
flow resistance in the second trimester: a screening study for pre-eclampsia and
intrauterine growth retardation. Br.J.Obstet.Gynaecol. 1991;98:871-79.
116. Bower S, Schuchter K, Campbell S. Doppler ultrasound screening as part of routine
antenatal scanning: prediction of pre-eclampsia and intrauterine growth retardation.
Br.J.Obstet.Gynaecol. 1993;100:989-94.
117. Bower S, Bewley S, Campbell S. Improved prediction of preeclampsia by two-stage
screening of uterine arteries using the early diastolic notch and color Doppler
imaging. Obstet.Gynecol. 1993;82:78-83.
118. Harrington K, Cooper D, Lees C, Hecher K, Campbell S. Doppler ultrasound of the
uterine arteries: the importance of bilateral notching in the prediction of pre-
eclampsia, placental abruption or delivery of a small-for-gestational-age baby.
Ultrasound Obstet.Gynecol. 1996;7:182-88.
119. Albaiges G, Missfelder-Lobos H, Lees C, Parra M, Nicolaides KH. One-stage
screening for pregnancy complications by color Doppler assessment of the uterine
arteries at 23 weeks' gestation(1). Obstet.Gynecol. 2000;96:559-64.
120. Papageorghiou A, Yu CKH, Bindra R, Pandis G, Nicolaides KH. Multicenter
screening for pre-eclampsia and fetal growth restriction by transvaginal uterine
artery Doppler at 23 weeks of gestation. Ultrasound Obstet.Gynecol. 2001;18:441-
49.
121. Chien PF, Arnott N, Gordon A, Owen P, Khan KS. How useful is uterine artery
Doppler flow velocimetry in the prediction of pre-eclampsia, intrauterine growth
retardation and perinatal death? An overview. BJOG. 2000;107:196-208.
122. Trudinger BJ, Giles WB, Cook CM. Uteroplacental blood flow velocity-time
waveforms in normal and complicated pregnancies. Br.J.Obstet.Gynaecol.
1985;92:39-45.
123. Alfirevic Z, Neilson JP. Doppler ultrasonography in high-risk pregnancies:
systematic review with meta-analysis. Am.J.Obstet.Gynecol. 1995;172:1379-87.
61
124. Baschat AA, Gembruch U, Harman CR. The sequence of changes in Doppler and
biophysical parameters as severe fetal growth restriction worsens. Ultrasound In
Obstetrics & Gynecology 2001;18:571-77.
125. Harrington K, Carpenter RG, Nguyen M, Campbell S. Changes observed in Doppler
studies of the fetal circulation in pregnancies complicated by pre-eclampsia or the
delivery of a small-for-gestational-age baby.I. Cross-sectional analysis. Ultrasound
In Obstetrics & Gynecology 1995;6:19-28.
126. Arduini D, Rizzo G, Romanini C. Changes of pulsatility index from fetal vessels
preceding the onset of late decelerations in growth-retarded fetuses. Obstet.Gynecol.
1992;79:605-10.
127. Rizzo G, Arduini D, Romanini C. Inferior vena cava flow velocity waveforms in
appropiate and small for gestational age fetuses. American Journal of Obstetrics and
Gynecology 1992;166:1271-80.
128. Vyas S, Nicolaides KH, Bower S, Campbell S. Middle cerebral artery flow velocity
waveforms in fetal hypoxemia. Br.J.Obstet.Gynaecol. 1990;97:797-803.
129. Hecher K, Campbell S, Doyle P, Harrington K, Nicolaides K. Assessment of fetal
compromise by doppler ultrasound investigation of the fetal circulation - arterial,
intracardiac, and venous-blood flow velocity studies. Circulation 1995;91:129-38.
130. Bahado-Singh RO, Kovanci E, Jeffres A, Oz U, Deren.O., Copel JA et al. The
Doppler cerebroplacental ratio and perinatal outcome in intrauterine growth
restriction. Am.J.Obstet.Gynecol. 1999;180:750-56.
131. Harrington K, Thompson MO, Carpenter RG, Nguyen M, Campbell S. In third
trimester fetuses the ratio in pulsatility index between the fetal descending thoracic
aorta and the middle cerebral artery may be more useful. Doppler fetal circulation in
pregnancies complicated by pre-eclampsia or delivery of a small for gestational age
baby. 2. Longitudinal analysis. Br.J.Obstet.Gynaecol. 1999;106:453-66.
132. Nicolaides KH, Economides DL, Soothill PW. Blood-gases, ph, and lactate in
appropriate-for-gestational-age and small-for-gestational-age fetuses. American
Journal of Obstetrics and Gynecology 1989;161:996-1001.
133. Rizzo G, Arduini D, Romanini C, Mancuso S. Doppler echocardiographic
assessment of atrioventricular velocity waveforms in normal and small for
gestational age fetuses. Br.J.Obstet.Gynaecol. 1988;95:65-69.
134. Groenenberg IA, Wladimirof JW. Relationship between fetal cardiac and extra-
cardiac Doppler flow velocity waveforms and neonatal outcome in intrauterine
growth retardation. Early Human Development 1991;26:185-92.
62
135. Al-Ghazaii W, Chita SK, Chapman MG, Allan LD. Evidence of redistribution of
cardiac output in asymmetrical growth retardation. Br.J.Obstet.Gynaecol.
1989;89:697-700.
136. Tchirikov M, Eisermann K, Rybakowski C, Schrder HC. Doppler ultrasound
evaluation of ductus venosus blood flow during acute hypoxemia in fetal lambs.
Ultrasound In Obstetrics & Gynecology 1998;11:426-31.
137. Gudmundusson S, Tulzer G, Huhta JC, Marsal K. Venous Doppler in the fetus with
absent end diastolic flow in umbilical artery. Ultrasound In Obstetrics &
Gynecology 1996;7:262-67.
138. Rizzo G, Capponi A, Soregaroli M, Arduini D, Romanini C. Umbilical vein
pulsations and acid base status at cordocentesis in growth retarded fetuses with
absent end diastolic velocity in umbilical artery. Biol Neonate 1995;68:163-68.
139. Ozcan T, Sbracia M, dAncona R, Copel JA, Mari G. Arterial and venous Doppler
velocimetry in the severely growth-restricted fetus and association with adverse
perinatal outcome. Ultrasound In Obstetrics & Gynecology 1998;12:39-44.
140. Ley D, Laurin J, Bjerre I, Marsal K. Abnormal fetal aortic velocity waveform and
minor neurological dysfunction at 7 years of age. Ultrasound In Obstetrics &
Gynecology 1996;8:152-59.
141. Ley D, Tideman E, Laurin J, Bjerre I, Marsal K. Abnormal fetal aortic velocity
waveform and intellectual function at 7 years of age. Ultrasound In Obstetrics &
Gynecology 1996;8:160-65.
142. Chan FY, Pun TC, Lam YH. Fetal cerebral Doppler studies as a predictor of
perinatal outcome and subsequent neurologic handicap. Obstet.Gynecol.
1996;87:981-88.
143. Divon MY, Girz BA, Langer O. Clinical management of the fetus with markedly
diminished umbilical artery end-diastolic flow. Am.J.Obstet.Gynecol.
1989;161:1523-27.
144. Rizzo G, Arduini D. Fetal cardiac function in intrauterine growth retardation.
Am.J.Obstet.Gynecol. 1991;165:876-82.
145. Romero R, Kalache KD, Kadar N. Timing the delivery of the preterm severely
growth-restricted fetus:venous Doppler,cardiotocography or the biophysical profile.
Ultrasound In Obstetrics & Gynecology 2002;19:118-21.
146. Bilardo CM, Wolf H, Stigter RH, Ville Y, Baez E, Visser GHA. Relationship
between monitoring parameters and perinatal outcome in severe, early intrauterine
growth restriction. Ultrasound In Obstetrics & Gynecology 2004;23:119-25.
63
147. Thornton JH. A randomised trial of timed delivery for the compromised preterm
fetus:short term outcomes and Bayesian interpretation. Br.J.Obstet.Gynaecol.
2003;110:27-32.
148. Thornton JH. Infant wellbeing at 2 years of age in the Growth Restriction
Intervention Trial (GRIT): multicentred randomised controlled trial. Lancet
2004;364:513-20.
149. Bowman JM, Penston LE. Fetomaternal trans-placental hemorrhage during
pregnancy and after delivery. VoxSang 1986;51:117-21.
150. Chavez GF, Edmonds LD. Epidemiology of Rh hemolytic disease of the newborn in
the United States. JAMA 1991;265:3270-74.
151. Martin JA, Hamilton BE, Park MM. Births: Final data for 2000. Natl.Vital.Stat.Rep.
2002;50:1-101.
152. Nicolaides KH, Thilaganathan B, Mibashan RS. Cordocentesis in the investigation
of fetal erythroblastosis. Am.J.Obstet.Gynecol. 1989;161:1197-200.
153. Whitfield CR. A three-year assessment of an action line method of timing
intervention in rhesus isoimmunization. Am.J.Obstet.Gynecol. 1970;108:1239-44.
154. Nicolaides KH, Rodeck C, Mibashan RS, Kemp JR. Have Liley charts outlived their
usulfulness? Am.J.Obstet.Gynecol. 1986;155:90-94.
155. Nicolaides KH, Rodeck C. Maternal serum anti-D antibody concentration and
assessment of rhesus isoimmunisation. BMJ 1992;304:1155-56.
156. Mari G, Gomez R, Copel JA, Blackwell SC. Noninvasive diagnosis by Doppler
ultrasonography of fetal anemia due to maternal red-cell alloimmnuzation.
Collaborative Group for Doppler Assessment of the Blood Velocity in Anemic
Fetuses. N.Engl.J.Med. 2000;342:9-14.
157. Nicolaides KH, Bilardo CM, Campbell S. Prediction of fetal anemia by
measurement of the mean blood velocity in the fetal aorta. Am.J.Obstet.Gynecol.
1990;162:209-12.
158. Vyas S, Nicolaides KH, Campbell S. Doppler examination of the middle cerebral
artery in anemic fetuses. American Journal of Obstetrics & Gynecology
1990;162:1066-68.
159. Scheier E, Hernandez-Andrade E, Carmo A, Dezerega V, Nicolaides KH.
Prediction of fetal anemia in rhesus disease by measurement of fetal middle cerebral
artery peak systolic velocity. Ultrasound in Obstetrics & Gynecology 2004;23:432-
36.
64
160. Figueroa J, Parra M, Valderrama O, Uriz A. Isoinmunization Rh: Evaluacin de la
utilidad del Doppler de arteria cerebral media en la prediccin y manejo de anemia
fetal. Rev.Chil.Obstet.Ginecol. 2003;68:197-206.
161. Sebire NJ, Snijders RJ, Hughes K, Sepulveda W, Nicolaides KH. The hidden
mortality of monochorionic twin pregnancies. Br.J.Obstet.Gynaecol.
1997;104:1203-07.
162. Derom R, Van der Berghe H. Perinatal mortality in the East Flanders prospective
twin pregnancies. Eur.J.Obstet.Gynecol.Reprod.Biol 1991;41:25-26.
163. Saunders NJ, Snijders RJ, Nicolaides K. Therapeutic amniocentesis in twin-twin
transfusion syndrome appearing in the second trimestre of pregnancy. Fetal
Diagn.Ther. 1992;6:36.
164. Hecher K, Ville Y, Nicolaides KH. Color Doppler ultrasonography in the
identification of communicating vessels in twin-twin transfusion syndrome and
acardiac twins. J.Ultrasound Med. 1995;14:37-40.
165. Sebire NJ, D'Ercole C, Hughes K, Carvalho M, Nicolaides KH. Increased nuchal
translucency thickness at 10-14 weeks of gestation as a predictor of severe twin-to-
twin transfusion syndrome [see comments]. Ultrasound Obstet.Gynecol.
1997;10:86-89.
166. Sebire NJ, D'Ercole C, Hughes K, Carvalho M, Nicolaides KH. Increased nuchal
translucency thickness at 10-14 weeks of gestation as a predictor of severe twin-to-
twin transfusion syndrome [see comments]. Ultrasound Obstet.Gynecol.
1997;10:86-89.
167. Sebire NJ, D'Ercole C, Carvelho M, Sepulveda W, Nicolaides KH. Inter-twin
membrane folding in monochorionic pregnancies. Ultrasound Obstet.Gynecol.
1998;11:324-27.
168. Senat MV, Deprest J, Ville Y. Endoscopic Laser Surgery versus Serial
Amnioreduction for Severe Twin-to-Twin Transfusion Syndrome. N.Engl.J.Med.
2004;351:136-44.
169. Nicolaides KH. Nuchal translucency and other first-trimester sonographic markers
of chromosomal abnormalities. Am.J.Obstet.Gynecol. 2004;in press.
170. Munoz, H., Puga, M., Valds, E., Matamala, P., Seplveda, E., and Parra, M.
Association of increased nuchal translucency and ductus venosous assessment
between 11 to 14 weeks of gestation. Ultrasound Obstet.Gynecol. 22(S1), 78.
2003.
Ref Type: Abstract
171. Bilardo CM, Muller MA, Zikulnig L, Schipper M, Hecher K. Ductus venosus
studies in fetuses at high risk for chromosomal or heart abnormalities: relationship
65
with nuchal translucency measurement and fetal outcome. Ultrasound
Obstet.Gynecol. 2001;17:288-94.
172. Martin, A. M., Bindra, R., Cursio, P., Cicero, S., and Nicolaides, K. H. Screening
for pre-eclampsia and fetal growth restriction by uterine artery Doppler at 11-14
weeks of gestation. Ultrasound In Obstetrics & Gynecology 18, 583-586. 2001.
Ref Type: Abstract
173. Albaiges G, Missfelder-Lobos H, Lees C, Parra M, Nicolaides KH. One-stage
screening for pregnancy complications by color Doppler assessment of the uterine
arteries at 23 weeks' gestation(1). Obstet.Gynecol. 2000;96:559-64.
174. Bindra R, Curcio P, Cicero S, Martin A, Nicolaides KH. Uterine artery Doppler at
11-14 weeks of gestation in chromosomally abnormal fetuses. Ultrasound
Obstet.Gynecol. 2001;18:587-89.
175. Martinez JM, Borrell A, Antolin E, Puerto B, Casals E, Ojuel J et al. Combining
nuchal translucency with umbilical Doppler velocimetry for detecting fetal
trisomies in the first trimester of pregnancy. Br.J.Obstet.Gynaecol. 1997;104:11-14.
176. Brown R, Di Luzio L, Gomes C, Nicolaides KH. The umbilical artery pulsatility
index in the first trimester: is there an association with increased nuchal
translucency or chromosomal abnormality? Ultrasound Obstet.Gynecol.
1998;12:244-47.
177. Felicetti M, Domenico AD, Salzano P, Borrelli P, Laboccetta A, Borrelli AL. The
importance of high resolution transvaginal sonography in early screening of fetal
chromosomal pathology. Clin.Exp.Obstet.Gynecol. 2001;28:53-54.
178. Reed KL, Sahn DJ. Doppler studies of vena cava flows in human fetuses: insights
into normal and abnormal cardiac physiology. Circulation 1990;81:498-505.
179. Brown RN, Di Luzio L, Gomes C, Nicolaides KH. Firts trimester umbilical venous
Doppler sonography in chromosomal normal and abnormal fetuses. J.Ultrasound
Med. 1999;18:543-46.
You might also like
- Interpretacion de Examenes de Laboratorio PDFDocument21 pagesInterpretacion de Examenes de Laboratorio PDFJose100% (3)
- GuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisFrom EverandGuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisRating: 4 out of 5 stars4/5 (9)
- Conceptos Y Estrategias En Terapia RespiratoriaFrom EverandConceptos Y Estrategias En Terapia RespiratoriaRating: 4 out of 5 stars4/5 (1)
- Flujometria DopplerDocument24 pagesFlujometria DopplerLorena TapiaNo ratings yet
- Cambios Fisiologicos en El EmbarazoDocument48 pagesCambios Fisiologicos en El EmbarazoKrysteel González100% (3)
- 03 Doppler Obtetrico-1Document95 pages03 Doppler Obtetrico-1Elida AdrianaNo ratings yet
- Sufrimiento FetalDocument19 pagesSufrimiento FetalAngel Enrique Rodriguez AlvarezNo ratings yet
- Flujos VenososDocument8 pagesFlujos VenososCami NogueiraNo ratings yet
- Ecocardiografia FetalDocument59 pagesEcocardiografia FetalAnonymous IZZYKJISANo ratings yet
- Evaluación Biofísica Fetal II PDFDocument5 pagesEvaluación Biofísica Fetal II PDFJohan LozanoNo ratings yet
- Silabo Sexualidad 2019-IDocument102 pagesSilabo Sexualidad 2019-IAlf Garcia ParraguisNo ratings yet
- Doppler en Obstetricia 2013Document29 pagesDoppler en Obstetricia 2013Eduardo Quezada PeraltaNo ratings yet
- Ecografía Doppler Aplicaciones Fetales y Maternas SeleccionadasDocument37 pagesEcografía Doppler Aplicaciones Fetales y Maternas SeleccionadasReynaldo Ali MarazaNo ratings yet
- Medicina ModernaDocument4 pagesMedicina ModernaSoporte En LineaNo ratings yet
- Resumen Doppler en ObstetriciaDocument6 pagesResumen Doppler en ObstetriciaPamela Mikami R HiiragiNo ratings yet
- Cordon Umbilical Clases Dr. Mario (Intermedio)Document65 pagesCordon Umbilical Clases Dr. Mario (Intermedio)Francisco Juárez ramirezNo ratings yet
- La Circulación Fetal y NeonatalDocument4 pagesLa Circulación Fetal y NeonatalEliana Ocoró PeñaNo ratings yet
- Ecografía Del Cordón Umbilical y PlacentaDocument15 pagesEcografía Del Cordón Umbilical y PlacentaLaura LizardoNo ratings yet
- Compilado PreguntasDocument26 pagesCompilado PreguntasGeraldo Quiroz BaezaNo ratings yet
- DOPPLER EN OBSTETRICIA ArnaldoDocument8 pagesDOPPLER EN OBSTETRICIA ArnaldoJor CabreraNo ratings yet
- Formato de Tarea - Doppler ObstétricoDocument14 pagesFormato de Tarea - Doppler ObstétricoAlfonso Alejandro Santiago MarcosNo ratings yet
- Doppler de Circulación FetoplacentariaDocument14 pagesDoppler de Circulación FetoplacentariaLISBET YULIANA PEREZ PEREZNo ratings yet
- Tratamiento RCIUDocument10 pagesTratamiento RCIUFrank Anthony SCNo ratings yet
- Taller Doppler FetalDocument8 pagesTaller Doppler FetalLaura Patiño100% (1)
- Apunte Curso Imedba Residencias Medicas CompressDocument34 pagesApunte Curso Imedba Residencias Medicas CompressCONSTANZA MARIA SORAYA GARCÍANo ratings yet
- Fecundación Del Neonato - PDF Circulación Fetal y Neonatal: Revista Peruana de Cardiología: Julio - Setiembre 1993Document3 pagesFecundación Del Neonato - PDF Circulación Fetal y Neonatal: Revista Peruana de Cardiología: Julio - Setiembre 1993Grace Ivanna Almache MendozaNo ratings yet
- La Circulación Fetal y NeonatalDocument4 pagesLa Circulación Fetal y NeonatalJhonathan GarzonNo ratings yet
- Organización de Caso (FC)Document13 pagesOrganización de Caso (FC)Paula Andrea Carvajal MartinNo ratings yet
- Doppler Normal y PatologicoDocument34 pagesDoppler Normal y PatologicoAngelica GomezNo ratings yet
- Fisiologia Del Embarazo e Implicancia en AnestesiaDocument56 pagesFisiologia Del Embarazo e Implicancia en AnestesiaAldo Barrantes AguilarNo ratings yet
- Poli e Oligo HidramniosDocument32 pagesPoli e Oligo HidramniosMay MtzbNo ratings yet
- Cambios Fisiologicos en El EmbarazoDocument6 pagesCambios Fisiologicos en El Embarazojuan DnielNo ratings yet
- Doppler ObstétricoDocument3 pagesDoppler ObstétricoPaolo ManfrediNo ratings yet
- RCIUDocument15 pagesRCIUElio SergioNo ratings yet
- Protocol DopplerDocument7 pagesProtocol DopplerGabi Torreblanca BrunNo ratings yet
- Fisiología y Desarrollo Del Sistema Cardiovascular Neonatal Implicaciones AnestesiológicasDocument13 pagesFisiología y Desarrollo Del Sistema Cardiovascular Neonatal Implicaciones AnestesiológicasnerakhobbitNo ratings yet
- A 06 V 56 N 4Document5 pagesA 06 V 56 N 4nes_tor027746No ratings yet
- Circulación Colateral Pared AbdominalDocument31 pagesCirculación Colateral Pared AbdominalMatias GüntherNo ratings yet
- Circulación Fetal y Materno-PlacentariaDocument6 pagesCirculación Fetal y Materno-PlacentariaEdwin Frank Campos PrietoNo ratings yet
- Doppler en La Hipertension Portal en PediatriDocument12 pagesDoppler en La Hipertension Portal en PediatriCLaudia De la Cruz-MiTacNo ratings yet
- M3 Eco CardioDocument77 pagesM3 Eco CardioCENTRO DE MUJER A MUJERNo ratings yet
- Guia de Estudio Mefi 1Document7 pagesGuia de Estudio Mefi 1Catalina Oyarce BarbieriNo ratings yet
- Ecografia Doppler en Obstetricia LunesDocument63 pagesEcografia Doppler en Obstetricia LunesPamela Wheelock100% (3)
- Fisiología Del EmbarazoDocument41 pagesFisiología Del EmbarazoLeciram CallisayaNo ratings yet
- Trauma en El EmbarazoDocument6 pagesTrauma en El EmbarazoMarvi SolangeNo ratings yet
- Adaptación NeonatalDocument17 pagesAdaptación NeonatalMaría PazNo ratings yet
- Arterias UterinasDocument6 pagesArterias UterinasNorman Renier CastellónNo ratings yet
- Sufrimiento Fetal AgudoDocument31 pagesSufrimiento Fetal Agudocarlos carlosNo ratings yet
- IbarraNeonatalRCA91 2Document12 pagesIbarraNeonatalRCA91 2marielena amaral marronNo ratings yet
- Fisiologia Del Embarazo y FetalDocument10 pagesFisiologia Del Embarazo y FetalManuel Muñoz100% (17)
- Modificaciones GravídicasDocument7 pagesModificaciones GravídicasCorina MoncadaNo ratings yet
- Crecimiento Intrauterino Restringido RCIU SDocument50 pagesCrecimiento Intrauterino Restringido RCIU SellieromanezNo ratings yet
- Clase 2 Adaptacion Cardiorespiratoria RN Dr. FallaDocument35 pagesClase 2 Adaptacion Cardiorespiratoria RN Dr. FallaLuisFernandoIdrogoHuaranga100% (1)
- Liquidos Corporales: Líquido Cefalorraquídeo:: Stiven Camilo Cuaspa CortezDocument20 pagesLiquidos Corporales: Líquido Cefalorraquídeo:: Stiven Camilo Cuaspa CortezJhon Alexis M ArgoteNo ratings yet
- 37 Sufrimiento Fetal AgudoDocument43 pages37 Sufrimiento Fetal AgudoMarcel Caos60% (5)
- Resumenn Juli DopplerDocument6 pagesResumenn Juli DopplerALEJANDRA PINILLANo ratings yet
- Circulación Colateral Del Abdomen PDFDocument31 pagesCirculación Colateral Del Abdomen PDFdrAlbertoVVNo ratings yet
- RCIU VideoDocument16 pagesRCIU VideoJhordan NatividadNo ratings yet
- Cuadernillo PuerperioDocument17 pagesCuadernillo PuerperioFernanda ContrerasNo ratings yet
- Doppler de Arterias Uterinas - Predicción de Preeclampsia y RCIUDocument52 pagesDoppler de Arterias Uterinas - Predicción de Preeclampsia y RCIUR4pT0r666100% (2)
- Foramen Oval PulmonarDocument14 pagesForamen Oval Pulmonarjviva1No ratings yet
- Clore LaseDocument1 pageClore LasemedicinahumaNo ratings yet
- Patologia Del Adulto MayorDocument78 pagesPatologia Del Adulto MayorCarlos Alberto Caicedo MoreiraNo ratings yet
- Tema 10-Bloque II-Fisiologia Del Musculo PDFDocument7 pagesTema 10-Bloque II-Fisiologia Del Musculo PDFMarcelopablo7No ratings yet
- Metilxantinas. Cafeina, Aminofelina y Teofilina PDFDocument27 pagesMetilxantinas. Cafeina, Aminofelina y Teofilina PDFmedicinahumaNo ratings yet
- BETHESDADocument6 pagesBETHESDALina Marcela JaimesNo ratings yet
- Enfermedad Wilson +++Document19 pagesEnfermedad Wilson +++medicinahumaNo ratings yet
- Enfermedad de Crohn PDFDocument35 pagesEnfermedad de Crohn PDFdanuyesNo ratings yet
- Digitalicos - Mec. Accion PDFDocument10 pagesDigitalicos - Mec. Accion PDFmedicinahumaNo ratings yet
- 2 09 SistEndocrinoDocument18 pages2 09 SistEndocrinoGabriela Beatriz Ovando TorresNo ratings yet
- Signo de La Vela DerretidaDocument3 pagesSigno de La Vela Derretidamedicinahuma0% (1)
- Pulmón HúmedoDocument1 pagePulmón HúmedomedicinahumaNo ratings yet
- Hiperglicemia Intrahospita+++Document8 pagesHiperglicemia Intrahospita+++medicinahumaNo ratings yet
- MIGRAÑADocument24 pagesMIGRAÑAJhoe AlxNo ratings yet
- VertigoDocument6 pagesVertigoWilliam RicardoNo ratings yet
- 18 Fiebre Reumatica Artritis PostestreptococicaDocument11 pages18 Fiebre Reumatica Artritis PostestreptococicaJosé Luis Navarro RomeroNo ratings yet
- Escala ForrestDocument2 pagesEscala ForrestFabio Andres SalasNo ratings yet
- Fisiologia Cicatriz HeridadsDocument12 pagesFisiologia Cicatriz HeridadsmedicinahumaNo ratings yet
- Complement oDocument27 pagesComplement omauricioh1No ratings yet
- Escala de SarnatDocument1 pageEscala de SarnatmiguelNo ratings yet
- Asma InfantilDocument36 pagesAsma InfantilYolizma H. CamachoNo ratings yet
- 04REYNAGA1Y2Document27 pages04REYNAGA1Y2medicinahumaNo ratings yet
- Endocrinopatia Multiple1Document44 pagesEndocrinopatia Multiple1medicinahumaNo ratings yet
- Signo de La Vela DerretidaDocument3 pagesSigno de La Vela Derretidamedicinahuma0% (1)
- CONSTIPACIONDocument11 pagesCONSTIPACIONmedicinahumaNo ratings yet
- Pruebas de Funcion Pancreatic ADocument29 pagesPruebas de Funcion Pancreatic ARaul Jashua Galindo100% (1)
- Antifungico, Hoy AyerDocument12 pagesAntifungico, Hoy AyermedicinahumaNo ratings yet
- PROFOLDocument7 pagesPROFOLmedicinahumaNo ratings yet
- Síndrome de DiGeorge.Document4 pagesSíndrome de DiGeorge.medicinahumaNo ratings yet