Professional Documents
Culture Documents
Estados de La Materia Quimica
Uploaded by
Akiire210 ratings0% found this document useful (0 votes)
8 views5 pagesQuimica
Original Title
Estados de la materia quimica.docx
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentQuimica
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
8 views5 pagesEstados de La Materia Quimica
Uploaded by
Akiire21Quimica
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 5
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
Santiago Mario
EXTENSIN MATURN
Ing. Civil COD.: 42
Estados de la materia
Profesor:
Eduardo Velsquez
Asignatura: Qumica
Bachilleres:
Jeanny Caraballo
Dahiannys Lopez
Luis Alejandro Manrique
Carla Roman
Erika Sebastiani
Maturn, 05 de noviembre del 2014
ndice
Variables de la ecuacin de estado de un gas ideal (PV=NRT) a partir de las leyes
de los gases y reconocer los ajustes para un gas real.
Relacione las propiedades de los materiales a partir del tipo de enlace que tiene su
estructura.
Explique por medio de arreglos geomtricos moleculares de los electrones de
valencia 5 compuestos de momento magntico 0.
En qu principio de fundamenta los anlisis con rayos x en solidos cristalinos.
Por qu los polmeros son Isotrpicos?
Variables de la ecuacin de estado de un gas ideal (PV=NRT) a partir de las leyes
de los gases y reconocer los ajustes para un gas real.
Ecuacin de estado de un gas ideal
La ecuacin de estado ms sencilla es aquella que describe el comportamiento de un
gas cuando ste se encuentra a una presin baja y a una temperatura alta. En estas
condiciones la densidad del gas es muy baja, por lo que pueden hacerse las siguientes
aproximaciones:
no hay interacciones entre las molculas del gas, el volumen de las molculas es
nulo. La ecuacin de estado que describe un gas en estas condiciones se llama ecuacin de
estado de un gas ideal.
La ecuacin de estado de un gas ideal es el resultado de combinar dos leyes empricas
vlidas para gases muy diluidos: la ley de Boyle y la ley de Charles.
Ley de Boyle
La ley de Boyle (1662) da una relacin entre la presin de un gas y el volumen que ocupa a
temperatura constante. Dicha ley establece que el producto de la presin por el volumen de
un gas a temperatura constante es constante. Matemticamente:
Ley de Charles
La ley de Charles (1787) establece que, a presin constante, el cociente entre el volumen
que ocupa un gas y su temperatura, expresada en kelvin (K), es una constante.
Isotermas de un gas ideal
La ecuacin de estado de un gas ideal depende de tres variables (p, V, T), pero es posible
representarla en dos dimensiones con ayuda del diagrama de Clapeyron o diagrama p - V.
Si en la ecuacin de estado de un gas ideal se fija el valor de la temperatura (por ejemplo
T1), la ecuacin resultante es:
Cada valor de la temperatura sustituido en la ecuacin de estado da lugar a una hiprbola.
Por construccin, todos los puntos de una misma hiprbola corresponden a estados en que
el gas ideal se encuentra a la misma temperatura, por lo que se denominan isotermas.
Cuanto mayor es la temperatura, ms arriba en el diagrama de Clapeyron se encontrar su
isoterma correspondiente.
En qu principio se fundamentan los anlisis con rayos X en solidos cristalinos
En la ley de Bragg, que explica la difraccin de los rayos x reflejados por planos
cristalinos paralelos, esta ley es comnmente conocida como cristalografa.
La cristalografa es una tcnica experimental utilizada para estudiar y analizar los
materiales. Los rayos x son difractados por medio de los electrones que rodean a los tomos
ya que su longitud de onda y la magnitud de su radio atmico son de igual orden.
El primero en realizar experimentos de cristalografa fue Max Von Lave, junto con
William Henry Bragg y William Lawrence Bragg (padre e hijo respectivamente)
Anteriormente a que Wilhem Conrad Rntgen descubriera los rayos x, ya exista la
idea de que los cristales son una repeticin peridica de un grupo de molculas, aunque las
distancias tpicas entre los planos de red cristalina se desconocan, se saba que deban ser
muy pequeas, en comparacin con la longitud de onda de la luz visible. Esto le dio a Von
Lave la idea de utilizar cristales de sulfato de cobre para ver si los rayos x eran partculas u
ondas: dedujo que si se trataba de ondas, se debera generar un patrn de difraccin al
atravesar los cristales. En 1912 con la ayuda de 2 exalumnos de Rntgen se realzan estos
estudios, confirmando la existencia de difraccin cristalina, que segn Von Lave, es la
extensin a tres dimensiones de la difraccin.
Poco tiempo despus, los britnicos Bragg reprodujeron el experimento, introduciendo de
esta manera la teora conocida como ley de Bragg.
Por qu los polmeros son Isotrpicos?
Son isotrpicos, es decir sus propiedades son iguales en todas las direcciones. Esto
se debe a la falta de regularidad en el ordenamiento de sus partculas, lo cual determina que
todas las direcciones sean equivalentes. La caracterstica ms notoria de estos materiales es
la ausencia de orden de largo alcance, lo cual significa que, al contrario de lo que ocurre en
un cristal, el conocimiento de las posiciones atmicas de una regin no nos permite
predecir cules sern las posiciones atmicas en otra regin ms o menos distante.
Los polmeros se producen por la unin de cientos de miles de molculas pequeas
denominadas monmeros que forman enormes cadenas de las formas ms diversas.
Algunas parecen fideos, otras tienen ramificaciones. Algunas ms se asemejan a las
escaleras de mano y otras son como redes tridimensionales. Existen polmeros naturales de
gran significacin comercial como el algodn, formado por fibras de celulosas. La seda es
otro polmero natural muy apreciado y es una poliamida semejante al nylon. La lana,
protena del pelo de las ovejas, es otro ejemplo. El hule de los rboles de hevea y de los
arbustos de Guayule, son tambin polmeros naturales importantes. Los polmeros tienen
una excelente resistencia mecnica debido a que las grandes cadenas polimricas se atraen.
Las fuerzas de atraccin intermoleculares dependen de la composicin qumica del
polmero y pueden ser de varias clases. Un polmero (del griego poly, muchos; meros,
parte, segmento) es una sustancia cuyas molculas son, por lo menos aproximadamente,
mltiplos de unidades de peso molecular bajo.
You might also like
- Ley Del Ejercicio de La Ingenieria - Erika Sebastiani 20%Document10 pagesLey Del Ejercicio de La Ingenieria - Erika Sebastiani 20%Akiire21No ratings yet
- Ensayo - Codigo de Hammurabi - Erika SebastianiDocument8 pagesEnsayo - Codigo de Hammurabi - Erika SebastianiAkiire21No ratings yet
- Capitulo II - BorradorDocument38 pagesCapitulo II - BorradorAkiire21No ratings yet
- Metodología de La InvestigaciónDocument16 pagesMetodología de La InvestigaciónAkiire21No ratings yet
- Talle - Concreto I - Teoria Plastica y ElasticaDocument5 pagesTalle - Concreto I - Teoria Plastica y ElasticaAkiire21No ratings yet
- Guía Práctica: Estacionamiento y Políticas de Reducción de Congestión. (BID, 2013)Document108 pagesGuía Práctica: Estacionamiento y Políticas de Reducción de Congestión. (BID, 2013)BICIRED - Red Nacional de Ciclismo UrbanoNo ratings yet
- Bases Legales - para Diseños Con Concreto ArmardoDocument3 pagesBases Legales - para Diseños Con Concreto ArmardoAkiire21No ratings yet
- Elementos Del Proyecto de InvestigaciónDocument12 pagesElementos Del Proyecto de InvestigaciónAkiire21No ratings yet
- Capitulo III - Marco Metodológico - Proyecto de InvestigaciónDocument7 pagesCapitulo III - Marco Metodológico - Proyecto de InvestigaciónAkiire21No ratings yet
- Variabilidad UniDocument7 pagesVariabilidad UniAkiire21No ratings yet
- Talle - Concreto I - Teoria Plastica y ElasticaDocument5 pagesTalle - Concreto I - Teoria Plastica y ElasticaAkiire21No ratings yet
- Metodología de La InvestigaciónDocument16 pagesMetodología de La InvestigaciónAkiire21No ratings yet
- CurvasDocument1 pageCurvasAkiire21No ratings yet
- El Aeropuerto Como Terminal Aereo - Sin NombreDocument10 pagesEl Aeropuerto Como Terminal Aereo - Sin NombreAkiire21No ratings yet
- Instalaciones Electricas ResidencialesDocument22 pagesInstalaciones Electricas ResidencialesAkire' SebastianiNo ratings yet
- Distribucion de Frecuencia Absoluta-II CorteDocument3 pagesDistribucion de Frecuencia Absoluta-II CorteAkiire21No ratings yet
- Puentes atirantados: características y tiposDocument5 pagesPuentes atirantados: características y tiposAkiire21No ratings yet
- Vias de Comunicacion I - Plano HorizontalDocument7 pagesVias de Comunicacion I - Plano HorizontalAkiire21No ratings yet
- Asignacion de Fisica - Condensadores.Document14 pagesAsignacion de Fisica - Condensadores.Akiire21No ratings yet
- Presupuesto de Obra: Análisis, Elaboración y AjusteDocument12 pagesPresupuesto de Obra: Análisis, Elaboración y AjusteAkiire21No ratings yet
- Medición y codificación de partidas en proyectos civilesDocument9 pagesMedición y codificación de partidas en proyectos civilesAkiire21No ratings yet
- Medición y codificación de partidas en proyectos civilesDocument9 pagesMedición y codificación de partidas en proyectos civilesAkiire21No ratings yet
- El AceroDocument28 pagesEl AceroAkiire21No ratings yet
- CAPITULO I - Interacción EléctricaDocument45 pagesCAPITULO I - Interacción EléctricaThomas PrattNo ratings yet
- El CementoDocument12 pagesEl CementoAkiire21No ratings yet
- Asignacion de Fisica - Condensadores.Document14 pagesAsignacion de Fisica - Condensadores.Akiire21No ratings yet
- Mecanica Estatica - EstructuraDocument10 pagesMecanica Estatica - EstructuraAkiire21No ratings yet
- Trabajo de Dibujo TecnicoDocument9 pagesTrabajo de Dibujo TecnicoSantos Sangtuosi HernandezNo ratings yet
- Introduccion A La Ing Civil - Informes TecnicosDocument19 pagesIntroduccion A La Ing Civil - Informes TecnicosAkiire210% (1)
- Dec RolyDocument25 pagesDec RolyMaria NinNo ratings yet
- Carbapenems GlicolipopptidosDocument5 pagesCarbapenems GlicolipopptidosnnNo ratings yet
- HIPERTIROIDISMODocument29 pagesHIPERTIROIDISMOJair Cruz IsopoNo ratings yet
- ASTM D 523 (Autoguardado)Document9 pagesASTM D 523 (Autoguardado)ricardoNo ratings yet
- Parcial Teoria de Las OrganizacionesDocument43 pagesParcial Teoria de Las OrganizacionesCatalina Camacho85% (34)
- Como Se Puede Ser Feliz A Pesar de Tener HambreDocument1 pageComo Se Puede Ser Feliz A Pesar de Tener HambreRichard SequeraNo ratings yet
- Resumen MactorDocument4 pagesResumen MactorhafelinNo ratings yet
- Examen de Etica IDocument5 pagesExamen de Etica IJohn Alex Garay BuendiaNo ratings yet
- El Texto Expositivo y ArgumentativoDocument13 pagesEl Texto Expositivo y Argumentativogeminiskatty93No ratings yet
- Acupresión para Aliviar El Dolor de CabezaDocument2 pagesAcupresión para Aliviar El Dolor de CabezaYito Martínez100% (1)
- Padres y Maridos. Los Varones en La Familia - WainermanDocument28 pagesPadres y Maridos. Los Varones en La Familia - WainermanLuciaLavezzariNo ratings yet
- Fuentes Musicales Del Renacimiento en EspañaDocument8 pagesFuentes Musicales Del Renacimiento en EspañaConsuelo Prats RedondoNo ratings yet
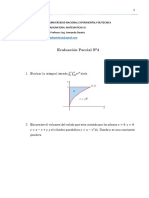
- Evaluación Parcial Nº4Document9 pagesEvaluación Parcial Nº4Hugo GuerraNo ratings yet
- Fichas 15Document6 pagesFichas 15Mirian CaballeroNo ratings yet
- Alquenos MonoDocument14 pagesAlquenos MonoDavid Fernando Chacon Candia0% (1)
- Integraciòn Regional (TP2 Oct 2022) 95%Document11 pagesIntegraciòn Regional (TP2 Oct 2022) 95%Carlos ArbitelliNo ratings yet
- Pelicula Los MiserablesDocument4 pagesPelicula Los MiserablesNancy Camelo Barreto100% (1)
- San Juan Bautista Tesis 2Document11 pagesSan Juan Bautista Tesis 2Brenda LlanosNo ratings yet
- La Teoria Etiquetamiento Labelling ApproachDocument24 pagesLa Teoria Etiquetamiento Labelling ApproachItzel Flores100% (1)
- Teoría volcánica y conflicto socialDocument1 pageTeoría volcánica y conflicto socialGINA NAYIBTH LEON VIDALNo ratings yet
- La Panaderã A de Pierre Hornea y Vende Pan Francã©sDocument3 pagesLa Panaderã A de Pierre Hornea y Vende Pan Francã©sGladys Falconi AlejandroNo ratings yet
- Actividad de Aprendizaje 3-Capítulo de "Considerandos" de Una Resolución Judicial. Segunda Parte-Damaris LunaDocument8 pagesActividad de Aprendizaje 3-Capítulo de "Considerandos" de Una Resolución Judicial. Segunda Parte-Damaris Lunamaria martinezNo ratings yet
- Avance Del Plan de Emergencia 3Document16 pagesAvance Del Plan de Emergencia 3Ronaldo Chisthiano VelasquezNo ratings yet
- Diseñando Un Pae (Proyecto de Aplicacion Escolar)Document10 pagesDiseñando Un Pae (Proyecto de Aplicacion Escolar)Neto Villanuevaa83% (6)
- TIOUREACIONDocument9 pagesTIOUREACIONCamilo SanaNo ratings yet
- Astronomia MayaDocument15 pagesAstronomia MayaAlejandro H. SánchezNo ratings yet
- Dossier de Calidad - Mejoramiento de Almacen de Panetones - Gloria HuachipaDocument6 pagesDossier de Calidad - Mejoramiento de Almacen de Panetones - Gloria HuachipaRuben Bendezu PizarroNo ratings yet
- Hemorragia Obstetrica DRDocument61 pagesHemorragia Obstetrica DRNectarTL21100% (1)
- Neurofisiología - Clase 1 ADocument48 pagesNeurofisiología - Clase 1 AClaudia FerreyraNo ratings yet
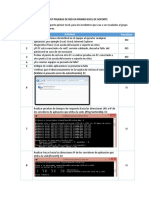
- Checklist pruebas red soporte primer nivelDocument3 pagesChecklist pruebas red soporte primer nivelOmar AxityNo ratings yet