Professional Documents
Culture Documents
Soluciones Miscibles e Inmiscibles
Uploaded by
Ledi MareléCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Soluciones Miscibles e Inmiscibles
Uploaded by
Ledi MareléCopyright:
Available Formats
I.
INTRODUCCIN
Una solucin es una mezcla homognea de especies qumicas dispersas a escala
molecular. Una solucin es una fases simple; el constituyente en mayor cantidad
es el solvente mientras que aquellos constituyentes (1 o ms) presentes en
cantidades relativamente pequeas se denominan solutos. Se ha llegado a una ley
lmite de la observacin del comportamiento de las soluciones; consideremos una
solucin compuesta de un disolvente voltil y uno o ms solutos no voltiles
La miscibilidad es parcialmente una funcin de la entropa, y por lo tanto se
observa ms comnmente en los estados de la materia que poseen ms entropa.
Los gases se mezclan con bastante facilidad, pero los slidos raramente son
miscibles. Dos excepciones notables a esta regla son las soluciones slidas de
cobre con nquel, y las de silicio con germanio usadas en electrnica.
La miscibilidad de dos materiales con frecuencia se puede determinar
pticamente. Cuando dos lquidos miscibles son combinados, el lquido resultante
es claro. S la mezcla tiene un aspecto turbio entonces los dos materiales son
inmiscibles. Si hablamos de soluciones miscibles nos referimos a la propiedad de
algunos lquidos para mezclarse en cualquier proporcin; pero las soluciones
inmiscibles, e refiere a que no pueden mezclarse entra mucho en funcin la
densidad.
SOLUBILIDAD.
La solubilidad es la mxima cantidad de soluto que se puede disolver en una
cantidad dada de disolvente a una temperatura dada. La solubilidad permite
predecir si se formara un precipitado cuando se mezclan dos soluciones o cuando
se agrega un soluto a la solucin.
Los compuestos se dividen en tres grandes categoras llamadas solubles,
ligeramente solubles e insolubles. Especficamente, para los lquidos se recurre a
trminos ms especficos: miscible e inmiscible. Aquellos lquidos que pueden
mezclarse entre s y formar una solucin acuosa son sustancias miscibles
(ejemplo: agua y alcohol), y los lquidos que no forman soluciones o son insolubles
entre s se denominan inmiscibles (ejemplo: agua y aceite).
Factores que afectan la solubilidad
La solubilidad de un compuesto en un determinado solvente depende de la
naturaleza qumica del soluto y solvente, la temperatura y la presin. La naturaleza
del soluto y del disolvente. La solubilidad aumenta entre sustancias cuyas
molculas son anlogas en sus propiedades elctricas y estructuralmente. Cuando
existe una similitud en las propiedades elctricas del soluto y solvente, se
incrementan las fuerzas intermoleculares, favoreciendo la disolucin de del soluto
en el solvente.
Efecto de la temperatura en la solubilidad
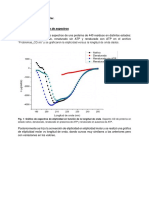
La temperatura de la solucin afecta la solubilidad de la mayora de
las sustancias. La figura 01 muestra la dependencia entre la
solubilidad en agua de algunos compuestos inicos y la temperatura.
Generalmente, la solubilidad de la sustancia slida se incrementa
con la temperatura. Fig.01. sustancias
inmiscibles
La solubilidad de los slidos en medio acuoso se expresa de acuerdo con la masa
de slido, en gramos, disueltos en 100 mL de agua (g/100 mL H2O), o bien la
masa de slido, en gramos, disueltos en 100 g de agua (g/100 g H2O). El
siguiente grfico muestra la solubilidad en agua de compuestos inicos en funcin
de la temperatura:
La solubilidad de los slidos en medio acuoso se expresa de acuerdo con la masa
de slido, en gramos, disueltos en 100 mL de agua (g/100 mL H2O), o bien la
masa de slido, en gramos, disueltos en 100 g de agua (g/100 g H2O). El
siguiente grfico muestra la solubilidad en agua de compuestos inicos en funcin
de la
temperatura:
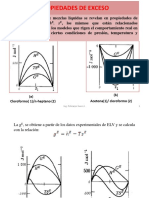
Fig. 02: Dependencia de la solubilidad con la temperatura de compuestos
inicos
La figura 02 muestra la dependencia de la solubilidad con la temperatura de
algunos compuestos inicos. En la mayora de los compuestos la solubilidad se
incrementa, al aumentar la temperatura, pero en el caso del Ce 2 (SO4)3 disminuye
y NaCl vara en un porcentaje menor.
Efecto de la presin en la solubilidad de los gases.
La presin externa tiene algn grado de influencia sobre la solubilidad de lquidos
y slidos, pero afecta sustantivamente la solubilidad de los gases. Existe una
relacin que permite cuantificar la solubilidad de los gases y la presin. Esta
relacin la proporciona la ley de Henry, que establece que la solubilidad de un gas
en un lquido es proporcional a la presin del gas sobre la disolucin. Esta ley la
podemos entender desde un punto de vista cualitativo, en donde la cantidad de
gas que se disolver en un solvente depende de cuan a menudo choquen las
molculas del gas con la superficie del lquido, y queden atrapadas por la fase
condensada.
SOLUCIONES MISCIBLES.
Se llama solucin miscible a aqulla en la que no hay interaccin entre sus partes
y por tanto cualquier magnitud conservativa y aditiva ser igual a la media
ponderada de los valores que corresponden a cada especie en su estado estndar
de referencia en esas condiciones de P y T.
SOLUCIONES INMISCIBLES.
Hace mucho tiempo atrs, alguien apareci con la idea de tomar dos polmeros y
combinarlos, con el objeto de obtener un material con propiedades intermedias
entre las de los polmeros por separado. Los materiales constituidos por dos
polmeros que se combinan se denominan mezclas. sin embargo no es muy usual
que dos polmeros se combinen entre s. En la mayora de los casos, si usted trata
de mezclar dos clases de polmeros, terminar con algo que parece una sopa de
pollo. Si observas una cacerola que contiene una buena sopa de pollo, vers que
tiene dos fases: una acuosa y otra con grasa de pollo. La grasa de pollo es
insoluble en agua, de modo que forma pequeas bolitas en la sopa, separadas de
la fase acuosa. As, decimos que las mezclas como la sopa de pollo son de fases
separadas.
Las mezclas o sistemas de fases separadas es justamente lo que se obtiene
cuando trata de combinar la mayora de los polmeros. Pero extraamente, los
materiales de fases separadas a menudo se transforman en cosas formidables y
tiles. Incluso hasta tenemos un nombre para ellas. Las llamamos sistemas
inmiscibles.
LEYES DE RAOULT Y HENRY
Si se desprecian las contribuciones debidas al volumen especfico en fase
condensada, los efectos de compresibilidad en fase gaseosa, y los coeficientes de
actividad (tanto en fase gaseosa como en fase condensada).
Hay dos casos de mezcla lquido-vapor sencillas: aqullas que verifican la ley de
Raoult para todos los componentes (suele llamarse mezcla heterognea ideal) y
aqullas en que el disolvente obedece la ley de Raoult y todos los solutos la ley de
Henry (la constante ki(T) se determina experimentalmente). Ntese que en el
primer caso la ley de Henry coincide con la de Raoult (ki(7')=l).Se ha notado que la
constante de Henry para un soluto dado no slo depende de la temperatura sino
de la naturaleza del disolvente.
Ley de Raoult (1887)
Ley de Henry (1 803)
You might also like
- Aplicacion Edo PDFDocument4 pagesAplicacion Edo PDFShely RiveraNo ratings yet
- Tarea 3 BMyE Marzo 2018 PDFDocument3 pagesTarea 3 BMyE Marzo 2018 PDFFlorencia FirenzeNo ratings yet
- Manejo de Tabla de Propiedades TermodinámicasDocument4 pagesManejo de Tabla de Propiedades TermodinámicasJose G Villarroel MNo ratings yet
- Espontaneidad y EquilibrioDocument16 pagesEspontaneidad y EquilibrioPaola MartinezNo ratings yet
- Tarea 6 Ecuación de WagnerDocument4 pagesTarea 6 Ecuación de WagnerLiliana TlahuechtlNo ratings yet
- 2da y 3era Ley TermodinamicaDocument21 pages2da y 3era Ley TermodinamicaXiomaraNo ratings yet
- Aromatizantes y Colorantes NaturalesDocument20 pagesAromatizantes y Colorantes NaturalesCoralia Leiva LópezNo ratings yet
- CUESTIONARIO QuimicaDocument6 pagesCUESTIONARIO Quimicagregory pardoNo ratings yet
- Practica JavonDocument13 pagesPractica JavonYahaira CastilloNo ratings yet
- 1 - Introduccion y Primer Principio Sistemas CerradosDocument7 pages1 - Introduccion y Primer Principio Sistemas CerradosNaiko CastellviNo ratings yet
- Coeficientes de actividad y ley de NernstDocument13 pagesCoeficientes de actividad y ley de NernstAlejandroxd45No ratings yet
- Apellidos Nombrespractica 2Document7 pagesApellidos Nombrespractica 2PamelaNo ratings yet
- Tipos filtros alimentosDocument8 pagesTipos filtros alimentosEstefania Castelan MartinezNo ratings yet
- Práctica 3 FenolDocument7 pagesPráctica 3 FenolEduardo Ruiz LopezNo ratings yet
- Ingeniería ambiental ecosistemas serviciosDocument18 pagesIngeniería ambiental ecosistemas serviciosRoberto Daniel Rivera CastroNo ratings yet
- Gonzalez Hernandez t1Document6 pagesGonzalez Hernandez t1Veneno Alan JoqsanNo ratings yet
- Propiedades Coligativas 1Document19 pagesPropiedades Coligativas 1Pablo PerezNo ratings yet
- Determinación del coeficiente de distribución del ácido benzoico entre agua y bencenoDocument7 pagesDeterminación del coeficiente de distribución del ácido benzoico entre agua y bencenoErikaCorderoLópezNo ratings yet
- Introduccion A La Mecanica de FluidosDocument5 pagesIntroduccion A La Mecanica de FluidosSebastian RodriguezNo ratings yet
- Practica 07-Transferencia de MasaDocument1 pagePractica 07-Transferencia de MasaAmayrani Figueroa DiazNo ratings yet
- Práctica 8 - Determinación de Velocidad de Reacción en Reactor Tipo BatchDocument9 pagesPráctica 8 - Determinación de Velocidad de Reacción en Reactor Tipo Batchluis_piestjNo ratings yet
- Distribucion de Acido Acetico Entre Agua y BencenoDocument11 pagesDistribucion de Acido Acetico Entre Agua y BencenoValeria TreviñoNo ratings yet
- Cuestionario Capitulo 5 BirdDocument3 pagesCuestionario Capitulo 5 BirdAdrian IbarraNo ratings yet
- Presión de SaturaciónDocument6 pagesPresión de SaturaciónJoseph Russtriân100% (1)
- Propiedades de ExcesoDocument30 pagesPropiedades de ExcesoElias Rodas PalominoNo ratings yet
- Práctica 4Document3 pagesPráctica 4AlejandraNo ratings yet
- 2 Peso Especifico y DensidadDocument3 pages2 Peso Especifico y DensidadPanela PierreNo ratings yet
- Mediciones calorimétricas: cálculo del calor de reacciónDocument3 pagesMediciones calorimétricas: cálculo del calor de reacciónT L Jho Jans WellNo ratings yet
- Evaporador Múltiple EfectoDocument49 pagesEvaporador Múltiple EfectoGONZALO MARQUEZ LIZARDONo ratings yet
- Método Del Análisis Dimensional de RayleighDocument3 pagesMétodo Del Análisis Dimensional de RayleighPaola Lilian Gonzalez TorralbaNo ratings yet
- Tema 1 Propiedades de Los Sistemas MulticomponentesDocument56 pagesTema 1 Propiedades de Los Sistemas Multicomponentessandra quevedoNo ratings yet
- Sistemas Multicomponentes Grupo 02 Trabajo FinalDocument26 pagesSistemas Multicomponentes Grupo 02 Trabajo FinalAllison JuarezNo ratings yet
- Prop Sistemas Multicomponentes VerDocument4 pagesProp Sistemas Multicomponentes VerLaura ReyesNo ratings yet
- Método Diferencial de La Cinética de Una ReacciónDocument12 pagesMétodo Diferencial de La Cinética de Una ReacciónLuis GamarraNo ratings yet
- CatalizadoresDocument18 pagesCatalizadoresValeria VelazquezNo ratings yet
- Ley de Los Estados CorrespondientesDocument7 pagesLey de Los Estados CorrespondientesKaren Soledad Sondor Maza0% (1)
- Volumenes Molares ParcialesDocument9 pagesVolumenes Molares ParcialesFranzMichaelSanchezAlbaNo ratings yet
- Practica 2 Termo FinalDocument12 pagesPractica 2 Termo FinalAnonymous jU0TwwINo ratings yet
- Tarea 2 Bioenergetica 1Document4 pagesTarea 2 Bioenergetica 1Brandon CaballeroNo ratings yet
- Fluidos NewtonianosDocument11 pagesFluidos NewtonianosJosué Villanueva QuirozNo ratings yet
- Propiedades fluidos U CundinamarcaDocument4 pagesPropiedades fluidos U CundinamarcaValentina Ortiz PlazasNo ratings yet
- Analisis de Resultados de La Primer Practica de Termodinamica UPIBI-IPNDocument4 pagesAnalisis de Resultados de La Primer Practica de Termodinamica UPIBI-IPNJuan Emanuel VGNo ratings yet
- (PDF) Practica de Laboratorio 3 Equilibrio Quimico y Principio de Le Chatelier - CompressDocument9 pages(PDF) Practica de Laboratorio 3 Equilibrio Quimico y Principio de Le Chatelier - CompressSantiago Rodriguez Rodriguez CaballeroNo ratings yet
- Difusividad y Los Mecanismos de Transporte de MateriaDocument4 pagesDifusividad y Los Mecanismos de Transporte de Materiaeugenia_gonzale3729No ratings yet
- Soluciones RealesDocument21 pagesSoluciones RealesFer CusimanoNo ratings yet
- Equilibrio Líquido Vapor en Sistemas BinariosDocument32 pagesEquilibrio Líquido Vapor en Sistemas BinariosAranza SantosNo ratings yet
- CAICEDO, Cristobal - EQUILIBRIO QUÍMICODocument133 pagesCAICEDO, Cristobal - EQUILIBRIO QUÍMICOYuri Jesus V.No ratings yet
- Reactor de Flujo en Pistón en Estado EstacionarioDocument4 pagesReactor de Flujo en Pistón en Estado EstacionarioKaren DaysNo ratings yet
- Fenómenos de Transporte - Capitulo 1Document32 pagesFenómenos de Transporte - Capitulo 1Yves Brunel GuerrierNo ratings yet
- Fundamento Teórico de Control de NivelDocument15 pagesFundamento Teórico de Control de NivelLUIS PERCY100% (1)
- 09-Transferencia de Masa Conveccion Natural y Forzada 2015 Rev2 PDFDocument7 pages09-Transferencia de Masa Conveccion Natural y Forzada 2015 Rev2 PDFRolando RivasNo ratings yet
- Fisicoquímica II: Ejercicios de equilibrio químico y cinéticaDocument2 pagesFisicoquímica II: Ejercicios de equilibrio químico y cinéticaDavis Camacho OcañaNo ratings yet
- Criterios para El Análisis de Sistemas ConcentradosDocument4 pagesCriterios para El Análisis de Sistemas ConcentradosJesus Romero PerezNo ratings yet
- Practica 6. Sintesis de Alquenos (Etileno)Document10 pagesPractica 6. Sintesis de Alquenos (Etileno)Javier AyalaNo ratings yet
- Correlaciones Generalizadas para LíquidosDocument1 pageCorrelaciones Generalizadas para LíquidosCATHERINE ALEJANDRA GALICIA RODRIGUEZNo ratings yet
- 6.8 SimulaciónDocument8 pages6.8 SimulaciónJuana GomezNo ratings yet
- Agua y Solubilidad de Sustancias QUIMICA IDocument7 pagesAgua y Solubilidad de Sustancias QUIMICA IDaniel Garcia100% (1)
- Solubilidad en Compuestos OrganicosDocument4 pagesSolubilidad en Compuestos OrganicosJeffry Merino PeraltaNo ratings yet
- Informe de Química Plan DiferenciadoDocument39 pagesInforme de Química Plan DiferenciadoBerit ChamorroNo ratings yet
- Primeros Auxilios en Caso de AccidenteDocument3 pagesPrimeros Auxilios en Caso de AccidenteLedi MareléNo ratings yet
- CUADRODocument1 pageCUADROLedi MareléNo ratings yet
- MonitoreoDocument4 pagesMonitoreoLedi MareléNo ratings yet
- Puente TraseroDocument6 pagesPuente TraseroLedi MareléNo ratings yet
- Planta de Producción FrigorificaDocument6 pagesPlanta de Producción FrigorificaLedi MareléNo ratings yet
- Marco TeoricoDocument8 pagesMarco TeoricoLedi MareléNo ratings yet
- Determinación de Proteína BrutaDocument5 pagesDeterminación de Proteína BrutaLedi MareléNo ratings yet
- FECHADocument1 pageFECHALedi MareléNo ratings yet
- ARBOLDocument1 pageARBOLLedi MareléNo ratings yet
- CD 3171Document154 pagesCD 3171Ledi MareléNo ratings yet
- Cuadro de Charlas y Capacitaciones Del Mes de Agosto 2019Document1 pageCuadro de Charlas y Capacitaciones Del Mes de Agosto 2019Ledi MareléNo ratings yet
- Charlas AgostoDocument21 pagesCharlas AgostoLedi MareléNo ratings yet
- Intro Ducci OnDocument1 pageIntro Ducci OnLedi MareléNo ratings yet
- Lluvia Ácida en El Centro Del PerúDocument7 pagesLluvia Ácida en El Centro Del PerúLedi MareléNo ratings yet
- LeyesDocument7 pagesLeyesLedi MareléNo ratings yet
- MECÁNICADocument5 pagesMECÁNICALedi MareléNo ratings yet
- Informe Cortinas RompevientosDocument1 pageInforme Cortinas RompevientosLedi Marelé50% (2)
- Auditoría-Estación de ServicioDocument3 pagesAuditoría-Estación de ServicioLedi MareléNo ratings yet
- Graficas de EjerciciosDocument5 pagesGraficas de EjerciciosLedi MareléNo ratings yet
- Extraccion de Aceite EsencialDocument8 pagesExtraccion de Aceite EsencialLeiZie ChiLonNo ratings yet
- Analisis Bromatologicos de Aceites y GrasasDocument82 pagesAnalisis Bromatologicos de Aceites y GrasasRicardo Cuevas Ruiz100% (1)
- Ejemplo de Planteamiento Del ProblemaDocument6 pagesEjemplo de Planteamiento Del ProblemaLedi MareléNo ratings yet
- Metodos AnaliticosssssDocument9 pagesMetodos AnaliticosssssLedi MareléNo ratings yet
- Descripcion Del NegocioDocument16 pagesDescripcion Del NegocioLedi MareléNo ratings yet
- Apuntes de Clase 2007la Politica FiscalDocument20 pagesApuntes de Clase 2007la Politica FiscalLedi MareléNo ratings yet
- INFORMEDocument2 pagesINFORMELedi MareléNo ratings yet
- Informe Cortinas RompevientosDocument1 pageInforme Cortinas RompevientosLedi MareléNo ratings yet
- BackusDocument2 pagesBackusLedi MareléNo ratings yet
- Metodos AnaliticosssssDocument9 pagesMetodos AnaliticosssssLedi MareléNo ratings yet
- TratadosDocument2 pagesTratadosLedi MareléNo ratings yet
- Metodos Generales de Obtencion de Los Principios Activos 2007Document25 pagesMetodos Generales de Obtencion de Los Principios Activos 2007Charytin Avalos50% (2)
- ChilcoDocument5 pagesChilcoDanie406No ratings yet
- Guía de solubilidad: factores que afectan la solubilidad de un sólido en un líquidoDocument6 pagesGuía de solubilidad: factores que afectan la solubilidad de un sólido en un líquidoCoryNo ratings yet
- Adhesivos Dentales Basados en 10 MDP TraDocument6 pagesAdhesivos Dentales Basados en 10 MDP Tracamilo pallesNo ratings yet
- Informe de Laboratorio #1 Manejo de Soluciones FisiológicasDocument7 pagesInforme de Laboratorio #1 Manejo de Soluciones FisiológicasEduardo Santana Reynoso MendozaNo ratings yet
- Universidad Nacional Del Santa Facultad de Ingeniería E. A. P. AgroindustrialDocument12 pagesUniversidad Nacional Del Santa Facultad de Ingeniería E. A. P. AgroindustrialDannika SaavedraNo ratings yet
- Extracción de grasas y aceites por SoxhletDocument3 pagesExtracción de grasas y aceites por SoxhletPatricia Candia MolinaNo ratings yet
- Elección Del DisolventeDocument2 pagesElección Del DisolventePriss AlmeeidaNo ratings yet
- Principios TeoricosDocument6 pagesPrincipios TeoricosMarcos QpNo ratings yet
- SolubilidadDocument10 pagesSolubilidadYo YoNo ratings yet
- Propiedades físicas y químicas de elementos y compuestosDocument7 pagesPropiedades físicas y químicas de elementos y compuestosJonathan AcuñaNo ratings yet
- Extracción Por Líquidos PresurizadosDocument3 pagesExtracción Por Líquidos PresurizadosNayelli CervantesNo ratings yet
- Informe 3 DestilaciónDocument10 pagesInforme 3 DestilaciónNicolas BuitragoNo ratings yet
- Trabajo Final FisicoquimicaDocument24 pagesTrabajo Final FisicoquimicaClaritsa QuiguanasNo ratings yet
- Standard Guide For Cleaning Metals Prior To Electroplating-EspaolDocument9 pagesStandard Guide For Cleaning Metals Prior To Electroplating-EspaolJulio EcheverryNo ratings yet
- F-GSS-027 - V1 Auditoria en Seguridad Salud Ocupacional y Medio Amb (HSE) A ContratistasDocument13 pagesF-GSS-027 - V1 Auditoria en Seguridad Salud Ocupacional y Medio Amb (HSE) A ContratistasAlex Palomino DiazNo ratings yet
- SolucionesPatEsp UNL23Document55 pagesSolucionesPatEsp UNL23Jenny Maria Chuncho ChapaNo ratings yet
- Trabajo de Grado Masilla Poliester PDFDocument100 pagesTrabajo de Grado Masilla Poliester PDFmel77868326No ratings yet
- Charlas Seguridad #126 A #150Document54 pagesCharlas Seguridad #126 A #150DANIEL ALEXANDER ZAPATA PINTONo ratings yet
- Extracción Continua y Discontinua (Química Orgánica)Document14 pagesExtracción Continua y Discontinua (Química Orgánica)Paola Thalia Loayza Merino71% (14)
- Taller QuimicaDocument17 pagesTaller QuimicaAndres PuentesNo ratings yet
- Reporte #6Document7 pagesReporte #6Isberto Martínez0% (1)
- Aceite PaltaDocument25 pagesAceite PaltaWalter Raul CulquiNo ratings yet
- Dicroismo Circular2018Document8 pagesDicroismo Circular2018Ariel Pinto MarchantNo ratings yet
- Practica 1 ToxicologiaDocument30 pagesPractica 1 ToxicologiaCezar Hernandez Cortes100% (1)
- Practica 1. TecnologiaDocument12 pagesPractica 1. TecnologiaDaniel MaguiñaNo ratings yet
- Cap 7 Extraccion Con Solventes Waquier Tomo 2Document27 pagesCap 7 Extraccion Con Solventes Waquier Tomo 2MiguelNo ratings yet
- 2 Cromatografia - Cuantificacion e Instrumentacion BDocument16 pages2 Cromatografia - Cuantificacion e Instrumentacion BDerek VleckNo ratings yet
- Estados de La MateriaDocument8 pagesEstados de La MateriaElissaNo ratings yet