Professional Documents
Culture Documents
BCM I 3 Como Ingresan Los Virus A La Celula Animal
Uploaded by
alfredo0 ratings0% found this document useful (0 votes)
40 views10 pagesTraduccion
Original Title
BCM I 3 Como Ingresan Los Virus a La Celula Animal
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentTraduccion
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
40 views10 pagesBCM I 3 Como Ingresan Los Virus A La Celula Animal
Uploaded by
alfredoTraduccion
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 10
Cmo ingresan los virus a la clula animal
Alicia E. Smith y Ari Helenius
Virus de replican dentro de clulas vivas y utilizan la maquinaria celular para la sntesis de su
genoma y otros componentes. Para acceder, ha desarrollado una variedad de elegantes
mecanismos para entregar sus genes y protenas accesorias en el host clula. Muchos de los
virus animales aprovechan vas endocticas y dependen de la clula para guiarlos a travs de
una entrada compleja y programa no capa. En el dilogo entre la clula y el intruso, la clula
proporciona seales importantes que permiten que el virus someterse a transformaciones
moleculares que conducen a la internalizacin exitosa, intracelular transporte y no capa.
Aunque es extremadamente simple en estructura y composicin, los virus son maestros del
camuflaje y el engao. Desprovisto de cualquier medio de independiente locomocin, difundir
explotando clulas y organismos. Con la ayuda de roedores, insectos y aves migratorias y
pasado a lo largo de comercio mundial y los viajes, se mueven alrededor del mundo con
velocidad asombrosa. Una vez que entran en el cuerpo de un husped potencial, pueden
penetrar capas de moco, desplazarse por el torrente sanguneo, y se dispersan con la ayuda
de clulas mviles y caminos neuronales. Un momento crtico se produce cuando un virus
partcula llega a una clula husped potencial y se fija s mismo a la superficie. Ahora debe
entregar sus protenas de la cpside y accesorio en la clula en forma de rplica-competente,
idealmente con un dao mnimo a la celda y dejando poca evidencia de su entrada para la
deteccin por el defensas inmunolgicas. Esto no es un problema trivial porque las
membranas celulares son impermeables a macromolculas.
Descripcin: Entrada de Virus y No capa
Partculas virales median la transferencia del genoma viral y protenas accesorias de una
clula husped infectado a una clula husped. La tarea implica el empaquetado del genoma
viral (ARN o ADN) y protenas accesorias, liberando el paquete de la clula infectada,
proteccin de los componentes esenciales durante transmisin extracelular y la entrega de
ellos en una nueva clula husped. Muchos virus con un genoma de ADN debe entrar en el
ncleo, mientras que los virus ARN, con pocas excepciones, replicar en el citosol. En general,
los virus utilizan una Estrategia de "Caballo de Troya" en el que la vctima asiste al intruso.
Para obtener asistencia de la clula husped, los virus utilizan la detallada "informacin
privilegiada" que han adquirido durante millones de aos de coevolucin con sus anfitriones.
En una partcula de virus animal tpico, la viral ARN o ADN se condensa en icosadrica o
complejos de nucleoprotena helicoidal llamados cpsida. En virus envueltos, la cpsida estn
rodeada por una bicapa lipdica que contiene glicoprotenas virales espiga. Adems, algunos
virus contienen reverso transcriptasas, RNA polimerasas, quinasas y otras protenas que son
importantes durante el uncoating, replicacin, u otros primeros pasos intracelulares. Para
infectar una clula blanco, procede de una partcula de virus a travs de un proceso de varios
pasos de la entrada, durante que cada paso est pre programado y firmemente regulada en
tiempo y espacio. La figura 1 muestra micrgrafos de electrn de algunos pasos de la entrada:
virus Unin a la clula, endocitosis y nuclear importacin. Otro paso crtico en la infeccin
proceso es no capa, durante el cual los lpidos envolvente debe ser cubierto y debe ser la
cpsida por lo menos parcialmente desmontados para exponer un genoma de rplica-
competente. Una vez no capa se ha producido, la movilidad del genoma dentro de la clula es
limitada. Avanzar en el ingreso y no capa programa depende de "seales" que proporciona la
clula. Seales incluyen interaccin con la superficie de la clula receptores, la exposicin a
pH bajo y reinmersin en un ambiente reductor. Estas seales activan disociacin y
programados los cambios conformacionales eventos en la partcula del virus. Para responder
a seales, las partculas de virus o algunas de sus protenas de componentes (tales como la
glicoprotenas de espiga) ocurren en metaestable y modificado fcilmente Estados
conformacionales. Cuando desencadenada por una seal, puede ser el estado meta estable
relajado para permitir cambios marcados en viral propiedades sin la aportacin de energa
externa. Aqu, describimos varios ejemplos de este proceso.
Receptores y factores de fijacin
Para infectar un virus primero deben adjuntar a la superficie de una clula. Las molculas que
lazo de virus constituyen una coleccin diversa de celulares protenas, carbohidratos y lpidos.
Se diferencian de un virus a la siguiente, y van desde abundante y omnipresente a rara y
especfica de la clula. Algunos de ellos simplemente sirven como factores de conexin que
se concentran virus en la superficie de la clula. Otros son verdaderos receptores que se unen
no slo virus pero tambin son responsables de guiar el lmite virus en vas endocticas y para
que transmite seales al citoplasma. Receptores de tambin puede servir como seales que
inducen conformacional cambios que conducen a la membrana fusin y penetracin. La
identidad y la distribucin de receptores y factores de fijacin determina en gran parte que
tipos de la clula tejidos y organismos que pueden infectar un virus. Algunos virus utilizan
mltiples factores de fijacin y los receptores en paralelo o en sucesin. En caso del virus de
inmunodeficiencia humana (VIH), 1, por ejemplo, contactos iniciales a menudo incluyen el
celular factores de fijacin de superficie tales como manosa encuadernacin tipo C lectina
receptores miembros de la familia, la adhesin intercelular de especfica de clulas dendrtica
molcula (ICAM) 3 apropiacin de nonintegrin (DCSIGN), o el hgado y los ganglios
linfticos especficos ICAM-3 apropiacin de nonintegrin (L-SIGN) (1, 2). Estas interacciones
iniciales no inducen conformacional cambios en la glicoprotena. Cuando la glicoprotena 120
(gp120) subunidad del virus envolvente se une a la inmunoglobulina exterior Dominio de G de
CD4, se somete a un conformacional cambio que permite que el virus asociado con sus
compaeros receptores, los receptores del chemokine CXCR4 o CCR5 (3). La interaccin
entre gp120 y CXCR4 o CCR5 desencadena la conversin de la subunidad de envolvente de
gp41 en la fusin-competente conformacin (4, 5). Una situacin similar se observa para
alphaherpes virus, para que heperan sulfato proteoglicanos sirven como factores de fijacin
inicial una de las glicoprotenas (gC). Membrana fusin es inducida por otras glicoprotenas
virales despus de interactuar con los receptores adicionales, como mediador de entrada
(HVE) de herpes virus, nectins, o integrinas (6). La interaccin individual entre un virus y un
factor nico adjunto o receptor puede ser dbil con una constante de Unin como milimolar (7,
8). Sin embargo, al multiplicar numerosos contactos, hace que la avidez atascamiento del
virus prcticamente irreversible. Envuelto virus como myxo paramyxoviruses se unen al
cido silico grupos tienen espiga de glicoprotenas con actividad de neuraminidasa. Sirven
como factores de destruccin del receptor liberan los virus encuadernados si estas partculas
virales incapaces de proceder en su entrada programa (9).
Protenas de unin a receptores
En virus envueltos, es las glicoprotenas de la espiga que unen a los receptores. A menudo
son protenas multifuncionales que sirve adems como factores de fusin de la membrana o
receptor de la destruccin enzimas. Datos estructurales en espiga existen interacciones de
glicoprotena, receptor de varios virus envueltos como hemaglutinina (HA) del virus de
influenza con lmite cido silico (7), de la gp120 del VIH-1 con lmite de CD4 (10), para la
glicoprotena D de herpes Simplex virus 1 (HSV-1) con lmite HVEA (11), para el gp42 del
virus Epstein Barr con antgeno del linfocito humano consolidado (HLA)-DR (12) y para la
enfermedad de Newcastle protena del virus HN con el beta-anomer del cido silico (13). En
virus no-envueltos, las estructuras que los receptores de bind son proyecciones o muescas en
la superficie de la cpside. Adenovirus tienen fibras homotrimeric prominentes con perillas
globulares que se proyectan desde cada uno de los 12 vrtices. La estructura cristalina de la
radiografa de la perilla de adenovirus 12, junto con el cJun dominio de los coxsackie y
adenovirus receptor (CAR), muestra un gran contacto rea en el lado lateral de cada
subunidad en el mando (14). La base del penton de muchos adenovirus subfamilias contiene
una RGD expuesta secuencia que se asocia con las integrinas (15). En rhino y enterovirus,
como la poliomielitis, los receptores se unen en una hendidura en la superficie cpside
llamada el "can" (16).
Para algunos virus, atascamiento puede causar desestabilizacin de las partculas de virus,
un primer paso hacia el no capa.
Atascamiento del virus: Carbohidrato/protena las interacciones
Interacciones de carbohidratos/protenas durante mucho tiempo se han sabido para
desempear un papel importante en la invasin viral (17). Algunos virus se unen
especficamente a los grupos que contengan cido silico, y otros se unen a
glicosaminoglicanos o glicolpidos. Heparn sulfato ha sido identificado como un factor
accesorio para virus herpes, virus adenoasociados, virus del dengue, virus de la encefalitis
tick-borne, virus del papiloma, paramixovirus 3 y virus Sindbis (6, 18 23). Para algunos de
estos, es importante el grado de sulfatacin de heparn sulfato o a la presencia de grupos
generados por Sulfotransferasas especficas (6, 24). En la mayora de los casos, hidratos de
carbono sirven como factores de conexin que desencadenan cambios conformacionales.
Simian virus 40 (SV40) y virus de polyoma utilizan los ganglisidos (GM1, GD1a y GT1b)
durante el accesorio (25, 26). En virus de polyoma, el disacrido cido silico 2, 3-galactosa
presente en los ganglisidos se une a un bolsillo poco profundo en la protena de la cpside
mayor, VP1(8). En algunos sistemas de virus, las lectinas se encuentra en la superficie celular
y el ligando de hidratos de carbono se encuentra en el virus. VIH-1, virus Sindbis, el virus del
Dengue, citomegalovirus humano, virus de la hepatitis C y virus de Ebola que todos se unen a
clulas lectinas superficiales, tales como DC-SIGN y L-SIGN, a travs de alta manosa glycans
N-ligados en sus glicoprotenas de envoltura (27 32).
Endocitosis
Muchos de los virus animales se basan en mecanismos endocticos de la clula de infeccin
productiva. La figura 2 muestra esquemticamente las vas endocticas entrada de tres virus
que se replican en el ncleo: adenovirus 2, influenza A y SV40. Una de las ventajas de
entrada endocticas es que virus se dan un "aventn" en el citoplasma. Esto es porque las
vesculas endocticas estn diseadas para atravesar las barreras impuestas por el
citoesqueleto cortical y el citoplasma altamente estructurado. Dependiendo del virus, las
partculas del virus pueden verse entrando en estructuras endosomal, lisosomas, el retculo
endoplsmico (ER) y vez en cuando el aparato de Golgi (33, 34). Otra ventaja de endocitosis
es que virus entrantes estn expuestos a entornos de compartimentacin que difieren desde
el medio extracelular. Para muchos virus, el pH ligeramente cido en endosomas una
referencia esencial que desencadena la penetracin y no capa (35-37). Penetracin de las
vacuolas intracelulares tambin tiene la ventaja de no dejar glicoprotenas virales expuestas
en la superficie celular para la deteccin inmune. Por ltimo, si la penetracin es ltica como
es el caso de los adenovirus, lisis de la membrana endosomal es probable que sea menos
perjudicial a la clula de la lisis de la membrana plasmtica. Un riesgo durante la endocitosis
es posible entrega el lisosoma, un compartimiento de degradacin y un callejn sin salida para
la mayora de los virus. Por esta razn los virus han ajustado cuidadosamente el pH de umbral
para la activacin para que coincida con la de temprano (pH<br>6 a 6.5) o finales endosomas
(pH 5-6) (38, 39). Que los endosomas tempranos y tardo constituyen sitios distintos de
entrada ha sido confirmado recientemente con mutantes dominantes negativos de endosomas
asociadas pequeas guanosina triphosphatases (GTPases)(40). Un mutante
constitutivamente inactivo de rab5 (endosome temprano) bloquearon la entrada del virus del
bosque Semliki (pH 6.2) y virus de la influenza (pH 5.4), mientras que el correspondiente
mutante rab7 (endosomas finales) slo bloquea entrada de virus de influenza. El avance de
las partculas del virus individuales a travs de compartimentos endocticos puede ser
rastreado con microscopia video en tiempo real (41 44). Las partculas del virus fluorescente
individual pueden observarse que se unen a la superficie celular, difuso a lo largo de la
membrana, atrapada en la tunica o caveolas, entrar por endocitosis, moverse a lo largo de
microtbulos y as sucesivamente. Con el uso de tintes fluorescentes especficos, se pueden
controlar la acidificacin de las partculas del virus y la fusin de la envuelta viral con las
membranas celulares.
Lpido balsa mediado Endocytosis del virus
SV40 y algunos otros virus eligen vas endocticas que endocitosis mediada por clatrina. Uno
de ellos involucra caveolae, en forma de matraz indentaciones de la membrana de plasma
enriquecidas en colesterol y esfingolpidos, caveolinas y factores de sealizacin (45-48).
Aunque generalmente inmviles, caveolas son conocidos por apoyar la internalizacin de
determinados ligandos fisiolgicos (49-51). Despus de atar al ganglisido GM1, SV40 se
mueve lateralmente a lo largo de la membrana plasmtica hasta que atrapado en un caveolas
(42, 52) (Fig. 2). Entrada procede a travs de una vescula caveolar, el caveosome y luego el
retculo endoplasmtico liso. Penetracin en el citosol se piensa para ocurrir en la sala de
urgencias, despus de que el virus entra en el ncleo a travs de los complejos de poro
nuclear (NPCs). Esta va tiene muchas caractersticas interesantes e inesperados [para
revisiones, ver (53 56)]. Caveolae tambin son utilizadas por el virus del polyoma en algunos
tipos de clulas, virus del papiloma y virus Echo 1 (57-60). Adems de las caveolas, es
evidente que las clulas tienen otras vas independientes de clatrina de endocitosis (55, 61).
Estos noncaveolar, lpidos balsa dependiente vas son todava mal caracterizado. Pueden
servir como una va de entrada principal para virus como el del polyoma (59, 62) y como una
va de entrada alternativo para SV40 en clulas falta caveolas (63). La presencia de mltiples
vas y organelos endocticos previamente incumplidos desafa supuestos establecidos sobre
la entrada de muchos virus. Procesos celulares pueden ser ms complejos de lo previsto, que
es ilustrada por la reciente observacin de que virus de la influenza, que pensaba entrar por
endocitosis hoyo revestido de clatrina, puede infectar a las clulas en que el transporte
vescula recubierta de clatrina es bloqueado (64).
Penetracin
Penetracin de virus envueltos se produce por fusin de membrana catalizada por protenas
de fusin de la envuelta viral. Los mecanismos implicados es bastante simple, al menos en
comparacin con el aparato necesario para los eventos de fusin de la membrana
intracelulares. Una razn de simplicidad es que factores de fusin virales se utilizan slo una
vez. Actividad de fusin se activa por seales en forma de atascamiento del receptor o de pH
bajo (segn lo mencionado arriba). Inducen, como regla general, los cambios
conformacionales irreversibles. Factores de fusin viral actualmente se dividen en dos clases
principales. Tipo I consisten en factores homotrimeric glicoprotenas de punto en el que las
subunidades se unen por bobinas de largo en espiral. Son protenas de membrana que se
sintetizan como protenas precursoras dobladas y montadas en oligmeros en la sala de
emergencia. En el transporte a travs de la va secretora sufren divisiones proteolticas
postsynthetic que hacen conformacionalmente meta estable y fusin competentes (4, 65). Su
estado meta estable permite conversin cooperativa en una conformacin de energa inferior.
Cuando se dispara, la conformacin resultante expone secuencias hidrofbicas fusin que
inserte en la membrana Diana. La energa libre liberada se utiliza para forzar las membranas
ms cerca juntos en un sitio focal, resultando en fusin. La gripe HA es el mejor estudiado de
esta clase. Para obtener ms informacin sobre este proceso bien estudiado, ver comentarios
recientes (5, 7, 66, 67). Protenas de fusin tipo II ocurren en flaviviruses y en alfa virus (68,
69). Tienen secuencias de fusin interna y se sintetizan y montados como heterodmeros con
otra protena de membrana. Cuando se expone a un pH bajo, se produce un cambio en la
estructura cuaternaria; la fusin disociar de sus parejas y se unen como activo homotrimers
(69-71). Fusin de la membrana es una manera elegante y eficaz para entregar cpsida viral
en el citosol. No asambleas macromoleculares que atraviesan una barrera de membrana
hidrofbica. El principio subyacente es el mismo que el trfico intracelular de la membrana; la
envoltura vrica es una "vescula de transporte", y la cpside es la carga. Porque
nonenveloped virus no tienen una membrana, penetran por lisis una membrana o mediante la
creacin de una estructura porelike en una membrana. Aunque los datos siguen siendo
obscuros, est claro que la penetracin de los virus no-envueltos implica tambin cooperativas
cambios en las partculas del virus por el atascamiento del receptor o un pH bajo (16, 72, 73).
Los virus se convierten ms hidrofbicos e interactan con las membranas directamente. De
adenovirus, se convierte en la base del penton ltica en pH bajo, y el virus es liberado de
endosomas roto intacto con el resto de contenidos endosomal (74, 75). Reovirus, en los que
est expuesto un pptido hidrofbico de la protena de la cpside 1, haciendo la cpside lticas
(76) utiliza una variacin del mismo tema. En el caso por picornavirus virus, atascamiento del
receptor al can conduce a la prdida de la protena VP4 y exposicin del grupo de cido
mirstico en el N terminal de VP1. El virus se cree que se hunden en la bicapa y formar un
"canal" de protena alineada a travs del cual el RNA viral puede entrar en el citosol (72).
IntracelularesTransporte
Despus de la penetracin, el genoma de la mayora de los virus debe ser transportado al
ncleo o a las membranas citoslicas especficas. Difusin en el citosol altamente
estructurado y llena de gente no es eficiente dadas las grandes dimensiones de la mayora de
la cpsida y las largas distancias que deben recorrer (77.78). Para moverse dentro de la
clula, virus entrantes a menudo explotan el celular y citoesqueleto protenas motoras.
Recientemente ha comentado (77), hay dos formas principales para hacer esto; el virus
pueden permitir las vesculas endocticas transportar como carga lumenal pasiva o la cpside
penetrada s mismo puede interactuar con los motores correspondientes. En este ltimo caso,
una protena de la cpside se une e interacta con los factores celulares. Transporte al ncleo
implica generalmente la dinena motor enddirected menos dependiente de microtbulos y sus
protenas del adaptador, dinactina. La actinia puede tambin desempear un papel en la
entrada de virus. Porque es rico en filamentos de la actinia, el citoesqueleto cortical plantea
una barrera contra el movimiento hacia el interior de la cpsida y virus que entran
directamente a travs de la membrana plasmtica (79). Para superar la barrera, algunos virus,
como el SV40, activan tirosina quinasa inducida por cascadas de seales que conducen a la
local disociacin de la actina filamentosa (52). Actina tambin se ha encontrado para
promover la brotacin en la superficie de la clula de la vescula y para propulsar las vesculas
endocticas que contiene el virus a travs del citoplasma (44, 52). El lanzamiento del
baculovirus de endosomas induce la polimerizacin de la actina a un extremo de la cpside
del baculovirus, que promueve movimiento de cpside hacia el ncleo (80). Una de las
protenas de la cpside (p78/83) tiene homologa con la protena mamfera de sndrome de
Wilkott-Aldrich (avispa) y por lo tanto es probable que interactuar con Arp2/3, un complejo de
protenas implicadas en el ensamblaje de actina (81).
Sealizacin durante la entrada de Virus
En los ltimos aos, ha quedado claro que el intercambio de informacin entre virus entrantes
y la clula husped no se limita a las seales que el virus de la clula. Para muchos virus,
toma la forma de un dilogo bidireccional en el que el virus aprovecha las ventajas de los
sistemas de transduccin de seal de celular para transmitir seales a la clula (82, 83). Estas
seales inducen cambios que facilitan la entrada, preparan la clula para la invasin y
neutralizan las defensas del anfitrin. Las seales generalmente se generan en la superficie
de la clula por el virus de la Unin a los receptores que son propios de sealizacin
molculas o moduladores (p. ej., receptores de factor de crecimiento, receptores del
chemokine, integrinas y ganglisidos) y pueden ser activadas por el atascamiento del virus o
inducida por el virus de la agrupacin. Miembros de la familia C de SV40 y adenovirus basan
su estrategia de entrada enteramente sobre la sealizacin (Fig. 2). Mediante la activacin de
cinasas de tirosina en las caveolas, SV40 activa la va de endocitosis de caveolar
ligandinducible normalmente inactivo. Una segunda seal es inducida en el caveosome inducir
caveosome a ER transporte (55). Por agrupamiento de sus receptores de entrada, adenovirus
2 activa una variedad de protenas quinasas, cinasa de fosfatidilinositol-3-OH y pequeas
GTPasas (82-84). Principales cambios en la dinmica superficial de la clula y en el transporte
mediado por microtbulos, que promueven la internalizacin, penetracin y trfico intracelular
de los virus entrantes. Citomegalovirus humano, virus herpes, activa varias vas de
sealizacin a travs de la interaccin entre la glicoprotena de envoltura B y el receptor del
factor de crecimiento epidrmico (85).
Importacin nuclear
El ncleo ofrece excelentes funciones de "servicio" para la replicacin del virus, hasta de DNA
y RNA polimerasas RNA splicing - modificar enzimas y. Sin embargo, el ncleo es difcil de
entrar y salir, y virus otra vez deben confiar en mecanismos celulares [para revisiones, ver (56,
86, 87)]. En las clulas de la interfase, la importacin de virus y cpsida viral se produce a
travs de los PNJs (Fig. 3). Para apuntar, los virus utilizan importacin citoslica receptores y
seales de localizacin nuclear. VIH-1 y adenovirus unen a 7 importin y virus del papiloma
humano 11 y 45, cpsida de virus de la hepatitis B, y nucleoprotenas de virus de influenza
son conocidas para enlazar importins y (88-92). Estudios recientes muestran que el lmite
mximo de dimetro de partcula para el transporte a travs de la APN es 39 nm (93). El ms
pequeo virus cpsida, como cpsida helicoidal en forma extendida, por lo tanto puede ser
importado en el ncleo sin desmontaje o deformacin. Entre partculas icosadricos,
parvovirus (dimetro 18 a 24 nm) y la cpsida del virus de la hepatitis B (dimetro 36 nm) es
probablemente importado intacto (94). La cpsida del virus de la hepatitis B es sin
recubrimiento en la cesta en la parte nuclear del complejo poro (95). Virus y cpsida tampoco
debe ser deformido o desarmar para permitir el genoma pasar a travs de la APN. Adenovirus
2 se une a NUP214 / puede, una protena localizada en la base de los filamentos que se
extienden en el citosol desde el poro nuclear (94) (Fig. 2). Interaccin dependiente del virus de
la histona H1 y importins y 7 induce desmontaje de la cpside del virus. El ADN viral liberado
se importa en el nucleoplasia. La cpsida de HSV-1 (dimetro 120 nm) tambin se unen a los
PNJs en un importin-forma dependiente, pero el ADN es liberado a travs de uno de los
vrtices icosadricos de la cpside sin ms desmontaje de cpside (96, 97). La cpside vaca
permanece ligada al complejo de poro para horas despus de que el ADN ha sido haban
expulsado (98). Con la excepcin de lentiviruses como VIH-1, retrovirus no utilizan los PNJs
para entrada nuclear. Preintegration complejos slo pueden entrar en el ncleo durante la
mitosis cuando la envoltura nuclear est temporalmente ausente, limitando su infectividad
para dividir las clulas. La base molecular para la absorcin nuclear de complejos
preintegration lentivirus no est del todo clara, pero hay pruebas de que tres protenas virales
son importantes: la protena de la matriz, la enzima integrasa y la pequea protena accesoria
vpr. Adems, se informa que una superposicin de triple hebra corta en el provirus de ADN
puede ser esencial al menos en algunas clulas. Discusin ms detallada de este tema, ver
(87, 99, 100).
Transferencia directa de clula a clula con y sin infeccin por el Virus
Por ltimo, la infeccin puede transmitirse directamente de clula a clula. Virus como el
sarampin, que expresan en la membrana plasmtica sobres protenas fusognicas a pH
neutro, a menudo inducen la fusin de clulas infectadas con clulas vecinas no infectadas.
As, los genes virales pasan directamente de clula a clula, y la infeccin ocurre sin la
participacin de partculas virales. En una estrategia alternativa para la transferencia de clula
a clula, las partculas del virus vaccinia extracelular se empujan prcticamente en una celda
adyacente por polimerizacin de la actina localizada en el interior de la clula infectada (101).
La polimerizacin de la actina se activa por una protena viral que recluta a la membrana
plasmtica avispa, Arp2/3 y otros factores celulares que promueven la polimerizacin de la
actina. La observacin que HIV-1 y otros lentivirus en algunos tipos celulares bud en vacuolas
endosome-como ha planteado la posibilidad de que las partculas del virus pueden ser
liberadas por la clula infectada de manera polarizada por medio de secrecin regulada (102).
Partculas de VIH-1 pueden, en este caso, directamente transmitirse de un macrfago a una
clula T como parte de la normal interaccin de clula a clula. Tambin hay pruebas de que
las clulas dendrticas, sin infectarse, pueden concentrar VIH-1 en las regiones de contacto
clula a clula y as promover infeccin (103, 104).
Perspectivas
Virus siguen planteando una grave amenaza para la vida y el bienestar de los seres humanos,
animales y otros organismos. En el pasado, la bsqueda de antivirales se centr
principalmente en replicases y otras enzimas virales. Que entrada y no capa pueden servir
como un destino para antivirales ha sido demostrado recientemente por nuevos inhibidores de
la neuraminidasa de la influenza y la protena de la fusin del VIH-1 (105, 106). Con nuestra
informacin rpidamente alcanzar el nivel molecular, es posible desarrollar nuevos enfoques
para bloquear la entrada de virus (107). Aprovechando su capacidad para entrar en las clulas
y expresar sus genes, virus se utilizan como vectores para la expresin de protenas
recombinantes en clulas y para la produccin de protenas. En terapia gnica, virus se
utilizan para entregar genes a las clulas y tejidos. Aunque todava hay muchos problemas
con esta forma de terapia, ms informacin sobre receptores del virus y los mecanismos de
entrada le ayudar a hacer virus ms seguro y ms tiles como herramientas teraputicas.
Anlisis de virus tradicionalmente ha proporcionado informacin sobre principios bsicos de la
expresin gnica, biologa molecular y cncer. Hoy en da, los virus son an poderosos en
muchas reas de investigacin, incluyendo biologa celular, biologa molecular e Inmunologa.
Anlisis cuidadoso de las interacciones virus-clula temprana es probable extender nuestra
comprensin an incompleta de la dinmica de la membrana del plasma, fusin de la
membrana, vas endocticas y muchos otros aspectos de la funcin celular.
Invasin bacteriana: Los paradigmas de patgenos enteroinvasivos
Bacterias invasoras activamente inducen su propia absorcin por fagocitosis en normalmente
las clulas nonphagocytic y luego ya sea establecer un nicho protegido dentro de la cual se
sobrevivir y replicarse o difusin de clula a clula mediante una actinia-basado proceso de
movilidad. Los mecanismos que subyacen la entrada bacteriana, maduracin del fagosoma, y
estrategias comunes de difusin revelan como nica tctica evolucionado por especies
individuales para establecer la infeccin.
Para establecer y mantener una infeccin exitosa, patgenos microbianos han evolucionado
una variedad de estrategias para invadir el host, evitar o resistir la respuesta inmunitaria
innata, daar las clulas y se multiplican en regiones especficas y normalmente estriles.
Basado en su capacidad para lidiar con estos asuntos crticos, las bacterias pueden agruparse
en diferentes categoras. Aqu Repasamos las bacterias invasoras supuestas, es decir, las
bacterias que son capaces de inducir su propia fagocitosis en clulas que normalmente estn
nonphagocytic. Nos centramos en las tcticas utilizadas por las bacterias enteroinvasive para
desencadenar su absorcin por las clulas epiteliales y discutir sus formas de vida
intracelulares. Los mecanismos de entrada y formas de vida de otros patgenos intracelulares
han sido revisados en otros lugares (1 4). Durante la fagocitosis por los fagocitos, las
bacterias desempean un papel pasivo. En contraste, durante la fagocitosis inducida por
bacterias, la bacteria es la clave y el jugador activo en la interaccin compleja entre el
microbio invasor y la clula husped (5). Otro componente importante es el citoesqueleto,
cuya plasticidad es crtico y ptimo de explotacin. Despus de la internalizacin, algunas
bacterias permanecen en una vacuola, que replican. Evitan la maduracin normal y el trfico
del fagosoma y perjudicar su normal actividad bacterioltica. Otras bacterias escapan de la
vacuola y replican en el citosol. En algunos casos, tambin se mueven y difundir por medio de
un proceso de movilidad actinia-basado. Cmo la clula detecta los intrusos bacterianos y
regula sus transcripcin y traduccin en los programas a su nueva vida con un parsito es un
tema importante. Apoptosis y antiapoptosis, as como ciclo celular y la inflamacin-
relacionados con la sealizacin de vas, se reprograman despus de la infeccin para ayudar
a la clula para sobrevivir el estrs inducido por la infeccin. El xito de una infeccin depende
de los mensajes que los dos jugadores, la bacteria y la clula enviar uno al otro. En cada
paso del proceso infeccioso de la bacteria aprovecha la maquinaria de la clula husped para
su propio beneficio.
Mecanismos de entrada
Para entrar en nonphagocytic clulas como las clulas epiteliales intestinales, algunos
patgenos microbianos expresan una protena de la superficie capaz de enlazar eucariotas
receptores de la superficie a menudo involucradas en adhesin cellmatrix o clula. Expresin
de esta protena conduce a la formacin de una vacuola que afecta a la bacteria a travs de
un proceso de "cerrar" relativamente modestos cambios citoesqueleto y membrana
extensiones ocurren en respuesta a la participacin del receptor. La interaccin inicial entre la
protena bacteriana y su receptor desencadenan una cascada de seales, incluyendo
fosforilaciones de protenas o reclutamiento de adaptadores y efectores y activacin de los
componentes del citoesqueleto que culminan en la internalizacin de Copa fagocitario
bacteriano y cierre. Otros patgenos han ideado mecanismos para enlazar una protena que
puede s mismo acto como puente entre la bacteria y un receptor de transmembrana, que
luego interviene en el proceso de entrada. Finalmente, agentes patgenos tambin pueden
saltarse el primer paso de adhesin e interactuar directamente con la maquinaria celular que
regula la dinmica del citoesqueleto de actina mediante la inyeccin de efectores a travs de
un sistema secretor. Las molculas efectoras causan grandes cambios citoesquelticos que
desencadenan la formacin de un bolsillo macropinocytic, ligada a la del cuerpo bacteriano.
El mecanismo de cremallera de entrada
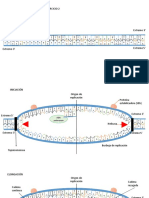
Yersinia pseudotuberculosis y Listeria monocytogenes aprovechar las protenas de adhesin
celular transmembrana como receptores para la entrada en las clulas mamferas (figs. 1A y
2A). Entrada se puede dividir en tres pasos sucesivos: (i) contacto y adherencia. Este paso es
independiente del citoesqueleto de actina e implica slo bacteriano ligando y su receptor.
Conduce al receptor de clustering. (ii) fagocitarias Copa formacin. Este paso es accionado
por las seales transitorias que ocurren despus de la formacin de los primeros complejos
ligando-receptor y propagar por el microbio invasor. Estas seales inducen actinia
polimerizacin y membrana de la extensin. (iii) fagocitarias Copa cierre y retraccin y
despolimerizacin de la actina. La invasin de la protena de membrana exterior de Yersinia se
une a los receptores de integrina que la con 1 y normalmente estn implicados en la adhesin
de clulas a la matriz extracelular (6). Invasin no posee el motivo RGD presente en la
fibronectina, pero ambas protenas interactan con integrinas por un dominio estructural
similar. Invasin tiene una mayor afinidad de las integrinas y pueden oligomerize, induce el
agrupamiento de integrinas y eficiente sealizacin corriente abajo. La cola citoplsmica de la
1 cadena, que normalmente interacta con el citoesqueleto en complejos focales de placas de
adherencia, es fundamental para la entrada, pero sorprendentemente, alteraciones de este
dominio que dificultar la interaccin con el citoesqueleto aumentan internalizacin. Por lo
tanto, una menor afinidad de la integrina para el citoesqueleto podra permitir mayor movilidad
de los receptores en la membrana. Activacin de integrinas conduce a eventos
tyrosinephosphorylation necesarios para la entrada. La tirosina quinasa FAK (quinasa de
adhesin focal) es el candidato ms atractivo para la transmisin de una seal de integrinas
agrupadas el citoesqueleto, porque el dominio citoplsmico de la cadena 1 se une a la FAK, y
dominantes - las mutaciones inhibitorias en FAK deterioran fuertemente mediada por la
invasin de absorcin (7). Fuente, fosfatidilinositol 3-quinasa (PI 3-quinasa), y
You might also like
- 1ro - Plan Lector - 1ra Actividad de DiciembreDocument1 page1ro - Plan Lector - 1ra Actividad de DiciembrealfredoNo ratings yet
- 1 PDFDocument10 pages1 PDFalfredoNo ratings yet
- Clase 12 RsptasDocument2 pagesClase 12 RsptasalfredoNo ratings yet
- Adn ReDocument4 pagesAdn RealfredoNo ratings yet
- FiorellaDocument7 pagesFiorellaalfredoNo ratings yet
- 1ro - Plan Lector - 1ra Actividad de DiciembreDocument1 page1ro - Plan Lector - 1ra Actividad de DiciembrealfredoNo ratings yet
- Clase 12 RsptasDocument2 pagesClase 12 RsptasalfredoNo ratings yet
- EjerciciosDocument2 pagesEjerciciosalfredoNo ratings yet
- Clase 12Document40 pagesClase 12alfredoNo ratings yet
- UNIDAD 5 Autonomía y Responsabilidad IndividualDocument3 pagesUNIDAD 5 Autonomía y Responsabilidad IndividualJocelyn Aranda RabanalNo ratings yet
- Adn ReDocument4 pagesAdn RealfredoNo ratings yet
- MurrayDocument1 pageMurrayalfredoNo ratings yet
- Clase 9. Naturaleza Del Gen y El Genoma 2020-2Document24 pagesClase 9. Naturaleza Del Gen y El Genoma 2020-2alfredoNo ratings yet
- Adn ReDocument4 pagesAdn RealfredoNo ratings yet
- HHDocument8 pagesHHalfredoNo ratings yet
- Helicobacter Pylori: y Enfermedades RelacionadasDocument5 pagesHelicobacter Pylori: y Enfermedades RelacionadasalfredoNo ratings yet
- Analisis CompetititvoDocument2 pagesAnalisis CompetititvoalfredoNo ratings yet
- Polimorfismo de MHC-IIDocument1 pagePolimorfismo de MHC-IIalfredoNo ratings yet
- Contaminación Del Parque AutomotorDocument29 pagesContaminación Del Parque Automotorwillgeiner100% (5)
- Contaminación Del Parque AutomotorDocument29 pagesContaminación Del Parque Automotorwillgeiner100% (5)
- La Sexualidad AnaliticaDocument1 pageLa Sexualidad AnaliticaalfredoNo ratings yet
- Guerra ADocument2 pagesGuerra AalfredoNo ratings yet
- Embarazo incipiente 5 semanas sin latido cardiacoDocument3 pagesEmbarazo incipiente 5 semanas sin latido cardiacoalfredoNo ratings yet
- Plan de Trabajo de FilosofiaDocument5 pagesPlan de Trabajo de FilosofiaalfredoNo ratings yet
- Articulo de OpinionDocument5 pagesArticulo de OpinionalfredoNo ratings yet
- Ensayo FinalDocument11 pagesEnsayo FinalalfredoNo ratings yet
- Informe Estadistico TerminadoDocument31 pagesInforme Estadistico TerminadoalfredoNo ratings yet
- Informe Estadistico TerminadoDocument31 pagesInforme Estadistico TerminadoalfredoNo ratings yet
- Informe EstadisticoDocument30 pagesInforme EstadisticoalfredoNo ratings yet
- Informe Estadistico TerminadoDocument31 pagesInforme Estadistico TerminadoalfredoNo ratings yet
- Manual Biologia CelularDocument54 pagesManual Biologia CelularFermínNo ratings yet
- Degeneracion y NecrosisDocument9 pagesDegeneracion y NecrosisSharon PeñalozaNo ratings yet
- Manual de Prácticas - Morfofisiología General 2022-2Document72 pagesManual de Prácticas - Morfofisiología General 2022-2Nini ZuNo ratings yet
- Pato p1 ESDocument18 pagesPato p1 ESJuan PachecoNo ratings yet
- Examen de Primer Parcial de Biologia Version 1 1s 2014Document5 pagesExamen de Primer Parcial de Biologia Version 1 1s 2014Jesy Fernanda100% (1)
- Cap 1. Robbins PatologíaDocument18 pagesCap 1. Robbins PatologíaTennessee PonceNo ratings yet
- Trabajo Academico I PDFDocument13 pagesTrabajo Academico I PDFismaelnoecruzNo ratings yet
- Preguntas Selectividad 2007-2011Document22 pagesPreguntas Selectividad 2007-2011Toni MartínezNo ratings yet
- Estructura Mitocondrial y FunciónDocument5 pagesEstructura Mitocondrial y FunciónDaniela Torres ZapataNo ratings yet
- Organización celular y tejidosDocument5 pagesOrganización celular y tejidosisabel niebles arenasNo ratings yet
- Monografia CelulaDocument15 pagesMonografia CelulaXesar Cesar Villalba100% (1)
- El Citoplasma BiologiaDocument6 pagesEl Citoplasma BiologiaSteeven Espinosa OtavaloNo ratings yet
- Bios Bioquim 4 A HamesDocument386 pagesBios Bioquim 4 A HamesPatrick Tejada Adriazola100% (1)
- Descubrimiento de La CélulaDocument16 pagesDescubrimiento de La Célulalobitoons30No ratings yet
- Compendio de Fisiología2Document239 pagesCompendio de Fisiología2Corpus Grageola RamirezNo ratings yet
- Aparato de Golgi Lisosomas y VacuolasDocument43 pagesAparato de Golgi Lisosomas y VacuolasscribdenesimoNo ratings yet
- 10 - Parcial de Biología Celular - 2020 Tema DDocument9 pages10 - Parcial de Biología Celular - 2020 Tema DDafne SaicoNo ratings yet
- Funcion Del Calcio en MitocondriaDocument32 pagesFuncion Del Calcio en MitocondriaBRAYAN0% (1)
- Audesirk Capítulo 05Document101 pagesAudesirk Capítulo 05enfermeria_unab_011100% (3)
- Biología Celular y Molecular - (CAPÍTULO 3. CITOPLASMA)Document50 pagesBiología Celular y Molecular - (CAPÍTULO 3. CITOPLASMA)Alejandro GuerreroNo ratings yet
- Teoria CelularDocument32 pagesTeoria CelularDaniela LealNo ratings yet
- Citoplasma y Microtubulos-2022Document36 pagesCitoplasma y Microtubulos-2022MARGARITONo ratings yet
- Cuestionario Teoria CelularDocument6 pagesCuestionario Teoria CelularVanessaSolarNo ratings yet
- Choice Biologia Con RtasDocument14 pagesChoice Biologia Con RtasMarianella PintoNo ratings yet
- Orgánulos No MembranososDocument5 pagesOrgánulos No Membranososalberto_fernandez_92100% (3)
- Citologia IIIDocument123 pagesCitologia IIIKaren Hr'No ratings yet
- Resumen Pato Cap 1 Patologia de ROBBINSDocument20 pagesResumen Pato Cap 1 Patologia de ROBBINSYadira de LunaNo ratings yet
- CITOLOGIADocument51 pagesCITOLOGIAFrankNo ratings yet
- CÉLULADocument9 pagesCÉLULARebeca lanauNo ratings yet
- Medio InternoDocument9 pagesMedio Internoyatselis RamrzNo ratings yet