Professional Documents
Culture Documents
2 Taller Icfes Termodinamica 2013
Uploaded by
Natalia Silva0 ratings0% found this document useful (0 votes)
283 views2 pagesEste documento presenta 16 preguntas de opción múltiple sobre conceptos de termodinámica como temperatura, calor, cambios de estado y calor específico. Las preguntas abarcan temas como las escalas Celsius y Fahrenheit, puntos de fusión y ebullición, gráficas de temperatura vs calor absorbido, y cálculos de calor involucrando masa, calor específico y cambios de temperatura.
Original Description:
Termodinamica establelcida para el año 2013
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentEste documento presenta 16 preguntas de opción múltiple sobre conceptos de termodinámica como temperatura, calor, cambios de estado y calor específico. Las preguntas abarcan temas como las escalas Celsius y Fahrenheit, puntos de fusión y ebullición, gráficas de temperatura vs calor absorbido, y cálculos de calor involucrando masa, calor específico y cambios de temperatura.
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
283 views2 pages2 Taller Icfes Termodinamica 2013
Uploaded by
Natalia SilvaEste documento presenta 16 preguntas de opción múltiple sobre conceptos de termodinámica como temperatura, calor, cambios de estado y calor específico. Las preguntas abarcan temas como las escalas Celsius y Fahrenheit, puntos de fusión y ebullición, gráficas de temperatura vs calor absorbido, y cálculos de calor involucrando masa, calor específico y cambios de temperatura.
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 2
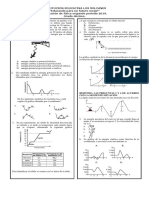
TALLER TIPO ICFES: TERMODINÁMICA
I.E MARÍA ANTONIA PENAGOS
Doc. Ana Milena Álvarez Ríos
Física grado 11 Mientras la bombilla permanece apagada la gráfica que
muestra la temperatura del hielo en función del tiempo es
1. De las siguientes temperaturas de 1 litro de agua a
presión de 1 bar, la menor es:
A. 273 K B. 32ºF C. -5ºC D. 250 K
2. La figura muestra una comparación entre las escalas
de temperatura centígrada y Fahrenheit
6. Estando el trozo de hielo a -20°C se enciende la
bombilla. A partir de este instante, acerca de la
temperatura del trozo de hielo se puede afirmar que:
A. no cambia, puesto que no hay materia entre la bombilla
y el hielo para el intercambio de calor
De la figura se puede concluir que
B. va aumentando, porque la radiación de la bombilla
A. 40°C es igual que 40°F comunica energía cinética a las moléculas del hielo
B. un cambio de temperatura de 1°C es equivalente a un C. no cambia puesto que no hay contacto entre la
cambio de temperatura de 1,8°F superficie de la bombilla y la del hielo
C. 0°C es igual que 0°F D. aumenta, porque la luz de la bombilla crea nueva
D. un cambio de temperatura de 1°F es equivalente a un materia entre la bombilla y el hielo, que permite el
cambio de temperatura de 1,8°C intercambio de calor
3. El punto normal de ebullición del agua es 100°C y el
RESPONDA LAS PREGUNTAS 7 Y 8 DE ACUERDO
punto normal de fusión del agua es 0°C. De la figura se
CON LA SIGUIENTE INFORMACION
puede afirmar que en la escala Fahrenheit estos mismos
puntos para el agua son
La siguiente es la gráfica de la temperatura de 1 kg de
A. 180°F y 32°F
helio como función del calor que éste absorbe a presión
C. 0° F y 212°F
atmosférica.
B. 212°F y 32°F
D. 180°F y 100°F T(k)
4. Desde hace mucho tiempo, sobre una mesa se 14
encuentran un recipiente con agua, un pedazo de madera 12
y un trozo de vidrio. Simultáneamente, se coloca un 10
termómetro en cada uno de estos objetos. Es correcto Gaseoso
afirmar que la lectura 8
4 Líquido
A. En los tres termómetros será la misma
B. Del termómetro del agua es mayor que las otras dos 25 45 65 85 105 Q(kJ)
Calor
C. Del termómetro del vidrio es mayor que las otras dos
7. El calor latente de una sustancia es la cantidad de calor
D. Del termómetro de la madera es mayor que las otras
por unidad de masa necesaria para que la sustancia
dos
sufra un cambio de estado. De acuerdo con esto, el
calor latente de evaporación del helio según la gráfica es
5. Dentro de una caja hermética, de paredes totalmente
aislantes y al vacío, se halla un trozo de hielo a -20oC. La
A 45 kJ/kg. B. 35 kJ/kg. C. 25 kJ/kg. D.20 kJ/kg.
caja contiene una bombilla inicialmente apagada.
8. De la gráfica se puede concluir que a 4 K, la muestra
de helio
A. Absorbe calor sin elevar su temperatura.
B. Absorbe calor y, así mismo, eleva su temperatura.
C.Mantiene constante el calor absorbido y su temperatura.
D. Mantiene constante el calor absorbido y aumenta su
temperatura.
9. Al graficar el punto de ebullición (Tb) de diferentes 13. Se calientan 5g de agua de 15ºC a 19ºC. Si el calor
masas de un mismo líquido, la gráfica que se obtiene es específico del agua es 1 cal/gºC, el calor cedido al agua
en el proceso es
A. 75 cal B. 20 cal C. 95 cal D. 5 cal
RESPONDA LAS PREGUNTAS 14 Y 15 DE ACUERDO
CON LA SIGUIENTE INFORMACIÓN
El calor específico de una sustancia está definido por la
expresión en donde Q es el calor que es necesario
suministrar a la unidad de masa de esa sustancia para
que su temperatura aumente en una unidad.
Se tiene un calorímetro (recipiente construido para aislar
térmicamente su contenido del exterior) de masa
despreciable, con una masa de agua M a temperatura T.
10. A recipientes iguales que contienen respectivamente 1 14. Si Tf es la temperatura final del conjunto y C1 es el
litro, 2 litros y 3 litros de agua, se les suministra calor calor específico del agua y C2 el del cuerpo de masa m, el
hasta que llegan a sus puntos de ebullición. calor ganado por la masa de agua M es:
Respecto a la relación de estas temperaturas de ebullición A. MC2 (To – Tf)
se puede afirmar que es: B. mC2 (Tf – To)
C. MC1 (Tf – T)
A. igual en los 3 recipientes. D. mC1 (Tf – T)
B. mayor en el recipiente de 1 litro.
C. mayor en el recipiente de 3 litros. 15. De acuerdo con lo anterior, de las siguientes
D. menor en el recipiente de 3 litros. expresiones, la que es válida para el calor específico del
cuerpo de masa m, es
11. Si la temperatura inicial del agua en los tres
M (Tf−T) M (To−Tf)
recipientes es la misma, la cantidad de calor absorbida A. C1 B. C1
por el agua hasta el momento en que alcanza el punto de m (To−Tf) m (Tf−T)
ebullición es:
m (To−T) M (Tf−T)
A. la misma en los tres recipientes. C. C1 D. C1
M (Tf−To) m (T−To)
B. dependiente del volumen del agua e independiente de
la temperatura inicial. 16. Se tienen tres cuerpos iguales aislados del medio
C. dependiente del volumen del agua y de la temperatura ambiente, a temperatura T1, T2 y T3, tales que:
inicial. T1 > T3 > T2.
D. directamente proporcional al volumen del recipiente.
Se ponen en contacto como lo muestra la figura:
12. En la siguiente gráfica se observa el comportamiento
del volumen de 1 g de agua cuando se le aplica calor a
presión atmosférica.
Si la capacidad calorífica del cuerpo 1 es C, el calor que
éste cede al cuerpo 2 hasta alcanzar la temperatura de
equilibrio Tf vale:
A. C(T3 – T2)
B. C(Tf - T2)
C. C(T1 – Tf – T3)
D. C(T1 – Tf)
De acuerdo con la información contenida en la gráfica la
temperatura para la cual la densidad del agua es máxima
es
A. 8 °C B. 16 °C C. 0 °C D. 4 °C
You might also like
- Temperatura-conversiones-termometrosDocument2 pagesTemperatura-conversiones-termometrosJohana Estupiñan100% (1)
- Taller Tipo Icfes de Fisica Tema Leyes de NewtonDocument1 pageTaller Tipo Icfes de Fisica Tema Leyes de NewtonknodyNo ratings yet
- TERMODINAMICA Tipo IcfesDocument2 pagesTERMODINAMICA Tipo IcfesJonatan FrancoNo ratings yet
- Conversion Unidades de TemperaturaDocument1 pageConversion Unidades de Temperaturamoises mosquera quinteroNo ratings yet
- Taller Tipo Icfes FisicaDocument3 pagesTaller Tipo Icfes FisicaAndreaLopezNo ratings yet
- Presión hidrostática y flotaciónDocument33 pagesPresión hidrostática y flotaciónTeffa MancipeNo ratings yet
- Diagnostico Fisica Grado 7 2021Document2 pagesDiagnostico Fisica Grado 7 2021SERGIO LOPEZ50% (2)
- Preguntas Tipo ICFES FÍSICADocument2 pagesPreguntas Tipo ICFES FÍSICAMallorie Escobar50% (4)
- Cinemática - Mru PDFDocument2 pagesCinemática - Mru PDFCarlos Andres Figueroa100% (1)
- Evaluacion Tipo Icfes DensidadDocument3 pagesEvaluacion Tipo Icfes DensidadpavarosendoNo ratings yet
- Preguntas Tipo Icfes Movimiento OndulatorioDocument7 pagesPreguntas Tipo Icfes Movimiento OndulatorioCarlos AragonNo ratings yet
- Examen de Fisica 9-2Document1 pageExamen de Fisica 9-2JERSY PAOLA DIAZ ESCOBARNo ratings yet
- Evaluacion de Noveno 1p 217Document3 pagesEvaluacion de Noveno 1p 217Eduardo Castañeda17% (6)
- Taller Icfes Optica y SonidoDocument3 pagesTaller Icfes Optica y SonidojadazalopezNo ratings yet
- Preguntas Tipo Icfes ElectrostaticaDocument3 pagesPreguntas Tipo Icfes Electrostaticajuan100% (2)
- Preguntas Tipo Icfes Movimiento OndulatorioDocument7 pagesPreguntas Tipo Icfes Movimiento OndulatorioDionisio Jose Casarrubia FrancoNo ratings yet
- Guia Colombia AprendeDocument23 pagesGuia Colombia AprendeJuan Esteban Medina Molano100% (1)
- Icfes TermodinamicaDocument8 pagesIcfes Termodinamicacarloangarita80% (10)
- Propiedades del ion x+5 y equilibrio químicoDocument4 pagesPropiedades del ion x+5 y equilibrio químicoSara RamosNo ratings yet
- Preguntas Tipo Icfes Movimiento OndulatorioDocument7 pagesPreguntas Tipo Icfes Movimiento OndulatorioJohana Maslow Ruiz0% (1)
- Movimiento Circular IcfesDocument3 pagesMovimiento Circular IcfesOLMES GORDILLO VILLANUEVANo ratings yet
- GUIA FISICA GRADO 8 (3) HidrostáticaDocument5 pagesGUIA FISICA GRADO 8 (3) Hidrostáticajuan pabloNo ratings yet
- ICFES Mecánica de FluidosDocument2 pagesICFES Mecánica de Fluidosluchh50% (2)
- EscalasTemperaturaQuímicaDocument1 pageEscalasTemperaturaQuímicayolima vivasNo ratings yet
- PREGUNTAS - TIPO - ICFES - DE - LEY - DE - COULOMB - 11 - (1) - Nicolas NiñoDocument6 pagesPREGUNTAS - TIPO - ICFES - DE - LEY - DE - COULOMB - 11 - (1) - Nicolas NiñoDanith Yesenia TovarNo ratings yet
- Icfes - Electromagnetismo IDocument4 pagesIcfes - Electromagnetismo IAnonymous 1xjskfNo ratings yet
- Examen de Presion Hidrostatica - Grado 8Document1 pageExamen de Presion Hidrostatica - Grado 8luis eduardo hernandez100% (1)
- 1 Guía 3 Estado de La Materia 8°Document3 pages1 Guía 3 Estado de La Materia 8°Liliana Hernández100% (2)
- Guia 5 Presión de Vapor Parte 2Document2 pagesGuia 5 Presión de Vapor Parte 2Romario Angarita100% (1)
- Evaluacion Tipo Icfes Grado 11 DinamicaDocument1 pageEvaluacion Tipo Icfes Grado 11 DinamicaRafael Lerma100% (3)
- Taller de FluidosDocument2 pagesTaller de FluidosTomasERodriguezRomero82% (11)
- Guía 7-Física 11-Campo ElectricoDocument2 pagesGuía 7-Física 11-Campo ElectricoLuis CoronadoNo ratings yet
- Taller Tipo ICFES Quimica 9.3Document6 pagesTaller Tipo ICFES Quimica 9.3Jose David López CastilloNo ratings yet
- Preguntas para Examen Leyes de NewtonDocument3 pagesPreguntas para Examen Leyes de NewtonJaimeCortésNo ratings yet
- Prueba Posición Vs Tiempo 10º-Tipo IcfesDocument1 pagePrueba Posición Vs Tiempo 10º-Tipo Icfesfrevar1167% (6)
- EVALUACION UNIDAD 3 ACUSTICA Temas El Sonido y Sistemas Resonantes Tipo Prueba SaberDocument23 pagesEVALUACION UNIDAD 3 ACUSTICA Temas El Sonido y Sistemas Resonantes Tipo Prueba SaberALCIDES PAEZ SOTONo ratings yet
- Evaluacion-Tipo-Icfes-Densidad CLEI 5Document2 pagesEvaluacion-Tipo-Icfes-Densidad CLEI 5Erick David Martínez100% (1)
- Evaluacion Tipo Icfes DensidadDocument3 pagesEvaluacion Tipo Icfes DensidadJudajoNo ratings yet
- Guia de Ondas 1 Grado 9° PDFDocument3 pagesGuia de Ondas 1 Grado 9° PDFRamón Ocampo Gomez100% (2)
- Guia Didactica. 2. Fisica. Grado 8.Document3 pagesGuia Didactica. 2. Fisica. Grado 8.Edna Yanira Guzman GuzmanNo ratings yet
- Ley Coulomb 11Document6 pagesLey Coulomb 11Danith Yesenia Tovar100% (3)
- Evaluación Intermedia Segundo Periodo 11ºDocument2 pagesEvaluación Intermedia Segundo Periodo 11ºJose Baleta100% (1)
- Examen final de Física del primer períodoDocument3 pagesExamen final de Física del primer períodoJERSY PAOLA DIAZ ESCOBARNo ratings yet
- Diagnostico Fisica 9Document4 pagesDiagnostico Fisica 9sandra baronNo ratings yet
- Examen Prueba Saber Fisica de NovenoDocument3 pagesExamen Prueba Saber Fisica de Novenojulianseven100% (1)
- 10 Fisica 3pDocument3 pages10 Fisica 3phernandocastillos100% (1)
- Evaluación Tipo Icfes GasesDocument3 pagesEvaluación Tipo Icfes GasesSamali Pinzon Correa50% (2)
- Evaluacion de Fisica Grado 7Document2 pagesEvaluacion de Fisica Grado 7RAMSES ALVAREZ100% (1)
- Guia n9 Trabajo Potencia y Energia Icfes 2011Document2 pagesGuia n9 Trabajo Potencia y Energia Icfes 2011Richardson House100% (1)
- Evaluación Tipo Saber Ley de CoulombDocument1 pageEvaluación Tipo Saber Ley de Coulombwilson rodriguezNo ratings yet
- Diagnostico Fisica 9Document2 pagesDiagnostico Fisica 9maria carolina hernandez duque0% (1)
- Taller 11° OndasDocument2 pagesTaller 11° OndasSANDRA RAMOS33% (3)
- Evaluación Física - Grado UndécimoDocument3 pagesEvaluación Física - Grado UndécimoDIEGO GARCÍANo ratings yet
- Icfes TermodinamicaDocument8 pagesIcfes TermodinamicaJuan David Ramirez AvilaNo ratings yet
- Ex. II Periodo 11-1Document3 pagesEx. II Periodo 11-1luis orlando pinzonNo ratings yet
- 1p Grado 11Document3 pages1p Grado 11David esteban perez lassoNo ratings yet
- Icfes TermodinamicaDocument8 pagesIcfes TermodinamicaDiana L. CortésNo ratings yet
- Guia Fisica Calor y TemperaturaDocument3 pagesGuia Fisica Calor y TemperaturaJuanenseña Edris y Juan Sebastián PizarroNo ratings yet
- Termodinamica Grado 9 2019Document3 pagesTermodinamica Grado 9 2019paula florez jimenezNo ratings yet
- Taller Calorimetria Parte 2.Document1 pageTaller Calorimetria Parte 2.Aldo CastroNo ratings yet
- Piso 4Document1 pagePiso 4Natalia SilvaNo ratings yet
- Formato Acta de EntregaDocument2 pagesFormato Acta de EntregaNatalia SilvaNo ratings yet
- DOC070122 MergedDocument14 pagesDOC070122 MergedNatalia SilvaNo ratings yet
- P00282 - Calle 93Document3 pagesP00282 - Calle 93Natalia SilvaNo ratings yet
- Piso 1 Adicionales 2Document1 pagePiso 1 Adicionales 2Natalia SilvaNo ratings yet
- Piso 1 Adicionales 2Document1 pagePiso 1 Adicionales 2Natalia SilvaNo ratings yet
- Piso 4Document1 pagePiso 4Natalia SilvaNo ratings yet
- Pedido de VentaDocument2 pagesPedido de VentaNatalia SilvaNo ratings yet
- 1126 Ctic D 1201 Localizacion Mobiliario Semisotano 20220304Document1 page1126 Ctic D 1201 Localizacion Mobiliario Semisotano 20220304Natalia SilvaNo ratings yet
- P00282 - Enel - Calle 93Document2 pagesP00282 - Enel - Calle 93Natalia SilvaNo ratings yet
- P00282 - Calle 93Document3 pagesP00282 - Calle 93Natalia SilvaNo ratings yet
- Encuesta para Personal Operativo de Construcción de La Localidad de FontibonDocument3 pagesEncuesta para Personal Operativo de Construcción de La Localidad de FontibonNatalia SilvaNo ratings yet
- P00282 - Calle 93Document3 pagesP00282 - Calle 93Natalia SilvaNo ratings yet
- Flwtrntvhujpamojkppz Hq4P4Ljxqw25Wdzs3Lx7 Ejgmtodm2Tmq Wz4Bvj4Mguxedgqc3Zr 5Ytwjpyrblwuau4Qpcs 7Kvtrp5JiggoyaDocument1 pageFlwtrntvhujpamojkppz Hq4P4Ljxqw25Wdzs3Lx7 Ejgmtodm2Tmq Wz4Bvj4Mguxedgqc3Zr 5Ytwjpyrblwuau4Qpcs 7Kvtrp5JiggoyaNatalia SilvaNo ratings yet
- 1126-Ctic-D-1208 - Localizacion Mobiliario Piso 7 - 20220304Document1 page1126-Ctic-D-1208 - Localizacion Mobiliario Piso 7 - 20220304Natalia SilvaNo ratings yet
- Encuesta para Trabajadores - Proceso de Contrataciòn.Document3 pagesEncuesta para Trabajadores - Proceso de Contrataciòn.Natalia SilvaNo ratings yet
- Sesión Sincrónica 2Document22 pagesSesión Sincrónica 2Natalia SilvaNo ratings yet
- Revista Virtual Universidad Católica Del Norte 0124-5821: Issn: Asanchezu@ucn - Edu.coDocument17 pagesRevista Virtual Universidad Católica Del Norte 0124-5821: Issn: Asanchezu@ucn - Edu.coNatalia SilvaNo ratings yet
- Acta Acabadosi - Unity Mob Nacional - 06.12.2021Document1 pageActa Acabadosi - Unity Mob Nacional - 06.12.2021Natalia SilvaNo ratings yet
- P00227 RocheDocument2 pagesP00227 RocheNatalia SilvaNo ratings yet
- Rut Americana de PinturasDocument3 pagesRut Americana de PinturasNatalia SilvaNo ratings yet
- Clima LaboralDocument9 pagesClima LaboralPEDRONo ratings yet
- P00227 RocheDocument2 pagesP00227 RocheNatalia SilvaNo ratings yet
- PL CIMBRA - UNI - ANTEPROYECTO - 211120-Plano - A1-0 - PLANTA ARQUITECTÓNICA - PISO 4.1-Layout2Document1 pagePL CIMBRA - UNI - ANTEPROYECTO - 211120-Plano - A1-0 - PLANTA ARQUITECTÓNICA - PISO 4.1-Layout2Natalia SilvaNo ratings yet
- P00227 RocheDocument2 pagesP00227 RocheNatalia SilvaNo ratings yet
- DerechoDocument217 pagesDerechorubenNo ratings yet
- Revista de Derecho Privado 1909-7794: E-Issn: Avega@uniandes - Edu.coDocument36 pagesRevista de Derecho Privado 1909-7794: E-Issn: Avega@uniandes - Edu.coMoises RamosNo ratings yet
- Scientia Et Technica 0122-1701: Issn: Scientia@utp - Edu.coDocument7 pagesScientia Et Technica 0122-1701: Issn: Scientia@utp - Edu.coNatalia SilvaNo ratings yet
- Contratos laboralesDocument26 pagesContratos laboralesYazmin Stella Senza LuceNo ratings yet
- Revista Virtual Universidad Católica Del Norte 0124-5821: Issn: Asanchezu@ucn - Edu.coDocument17 pagesRevista Virtual Universidad Católica Del Norte 0124-5821: Issn: Asanchezu@ucn - Edu.coNatalia SilvaNo ratings yet
- Termodinámica: Problemas resueltosDocument93 pagesTermodinámica: Problemas resueltosDaniel Sánchez Oxté84% (19)
- 01-Ciclos ConvencionalesDocument44 pages01-Ciclos ConvencionalesDanielNo ratings yet
- Derivados de Combustibles FósilesDocument3 pagesDerivados de Combustibles FósilesCristian OviedoNo ratings yet
- Taller de GasesDocument3 pagesTaller de GasesKevin Salcedo BermúdezNo ratings yet
- Practicas - Laboratorio de NucleosDocument7 pagesPracticas - Laboratorio de NucleosKevin Marco Chalco MalpartidaNo ratings yet
- Presentacion - HELIUM ONEDocument22 pagesPresentacion - HELIUM ONEJc MoranNo ratings yet
- Basic Seal Course SPANISHa 2005 MOADocument85 pagesBasic Seal Course SPANISHa 2005 MOAOmar Pérez100% (1)
- WPS Aluminio 6061 T6Document5 pagesWPS Aluminio 6061 T6Alvaro BurgosNo ratings yet
- Ejerccios Fisica Ii Termodinamica PDFDocument28 pagesEjerccios Fisica Ii Termodinamica PDFIng Manuel QuintNo ratings yet
- ?3° EDU-VACACIONES - CUADERNILLO VACACIONAL - ?esmeralda Te Enseña? - ?Document22 pages?3° EDU-VACACIONES - CUADERNILLO VACACIONAL - ?esmeralda Te Enseña? - ?Axel HernándezNo ratings yet
- Manual Cromatografo SriDocument25 pagesManual Cromatografo SriElkin Diaz0% (1)
- Tendencias periódicas: ejercicios de radio atómico, potencial de ionización y afinidad electrónicaDocument4 pagesTendencias periódicas: ejercicios de radio atómico, potencial de ionización y afinidad electrónicaTelmo BastidasNo ratings yet
- Guia de La 1 Ley de La TermodinamicaDocument1 pageGuia de La 1 Ley de La TermodinamicaAlvaro Pinto SáezNo ratings yet
- Evolución estelar: La vida y muerte de las estrellasDocument5 pagesEvolución estelar: La vida y muerte de las estrellasNoelia MittagNo ratings yet
- Ejercicios de CalorimetríaDocument1 pageEjercicios de CalorimetríaJavier DuqueNo ratings yet
- Practica #3 TermodinamicaDocument2 pagesPractica #3 TermodinamicaRamon Alberto GarciaNo ratings yet
- Informe Gases NoblesDocument15 pagesInforme Gases NoblesMario Martinez100% (1)
- 2 Cosmoquimica PDFDocument22 pages2 Cosmoquimica PDFStalin BryanNo ratings yet
- Metalurgia extractiva litioDocument24 pagesMetalurgia extractiva litiozammy21100% (2)
- Resonancia Magnética para Técnicos: Conceptos BásicosDocument47 pagesResonancia Magnética para Técnicos: Conceptos BásicosDiego Bilbao100% (2)
- Formación de helio y otros elementos en estrellas a través de la nucleosíntesis estelarDocument4 pagesFormación de helio y otros elementos en estrellas a través de la nucleosíntesis estelarvalentina robayoNo ratings yet
- Proceso de Recuperación y Licuefaccion de HelioDocument10 pagesProceso de Recuperación y Licuefaccion de HelioDanielaNo ratings yet
- Informe Grupo #2 (La Atmosfera)Document45 pagesInforme Grupo #2 (La Atmosfera)MarvinR.Mira100% (1)
- Clase de Soldadura.Document51 pagesClase de Soldadura.Jesus Aguirre RamosNo ratings yet
- QUIZ 3 Quimica InorganicaDocument17 pagesQUIZ 3 Quimica InorganicaJose JulianNo ratings yet
- Evolución de La Composición Química Del UniversoDocument5 pagesEvolución de La Composición Química Del UniversoJuan Fermin PachecoNo ratings yet
- Monografia GrafenoDocument10 pagesMonografia GrafenoCarlos Melo MedinaNo ratings yet
- CROMATOGRAFIA DE GASES-LibroDocument11 pagesCROMATOGRAFIA DE GASES-Librozephalik666No ratings yet
- Curso de Leak Testing (LT) Nivel I y II - Módulo 1 Emisión de BurbujaDocument93 pagesCurso de Leak Testing (LT) Nivel I y II - Módulo 1 Emisión de BurbujaOverhaul Mining Eirl100% (1)
- Ideas Con GlobosDocument25 pagesIdeas Con GlobosAlfredo Ernesto Mendez GrandeNo ratings yet