Professional Documents
Culture Documents
Joule Thomson Effect - En.es
Uploaded by
AngélicaPopayánOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Joule Thomson Effect - En.es
Uploaded by
AngélicaPopayánCopyright:
Available Formats
Joule Thomson-Efecto
do HRISTOPH W INDMEIER, Linde AG, Pullach (M € unchen), Alemania
R Y TODO F. B ARRON, Louisiana Tech University, Ruston, Estados Unidos
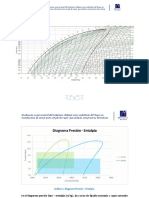
Un flujo de fluido encontrarse con un obstáculo como, curva, porque la pendiente de la línea isoentálpica es cero.
por ejemplo, una válvula de expansión, una placa de orificio, un
tapón poroso, o un tubo capilar, experimentará una caída de Muestran que la termodinámica el J-T
presión. Puesto que la transferencia de calor exterior y cambios coeficiente puede ser expresada en términos de propiedades
en la energía cinética son generalmente insignificantes, y porque volumétricas y calóricos como sigue:
no hay transferencia de trabajo desde y hacia el flujo de fluido, la
" #
expansión resultante puede ser considerada como isoentálpica.
metro JT ¼ 1 T@v v re 1 Þ
Un fluido no ideal será por lo tanto experimentar un cambio en la do pag @ T pag
temperatura. Este fenómeno fundamental se llama Joule-Thomson
( J-T) efecto y permite la producción de niveles de temperatura dónde v es el volumen específico y do pag el calor específico
fría por la expansión isoentálpica de líquidos de alta presión. a presión constante del material.
Puesto que un gas ideal no posee ningún fuerzas
intermoleculares uno puede esperar un valor de cero para su
El origen del efecto J-T se encuentra dentro de la ocurrencia coeficiente J-T. Sustituyendo la ecuación de estado de un gas
de las fuerzas intermoleculares en los fluidos no ideales: Una ideal v ¼ ( RT) / p en la ecuación 1 da:
reducción de la presión se acompaña de un aumento del volumen
específico. En consecuencia las distancias intermoleculares
promedio también aumentan. El trabajo interno realizado sobre @v
¼R
las interacciones atractivas o repulsivas dará lugar a un cambio @ T pag pag ¼ v T
respectivo de la temperatura del sistema. Las líneas de entalpía
constantes en el plano de presión con temperatura se muestran dónde R es la constante de los gases y pag es la presión.
en la Figura 1. El efecto del cambio de temperatura para un Sustituyendo en la ecuación 1 da metro JT ¼ 0 para un gas ideal.
cambio de isoentálpica de la presión está representado por la Para un gas real, el coeficiente de J-T puede ser negativo, cero
o positivo, dependiendo de la temperatura inicial y la presión
del material.
coeficiente de Joule-Thomson, metro JT, definido por
La ecuación simple de estado para gases reales es la van
der Waals ecuación de estado:
metro JT ¼ @ T
@ pag marido
pag þ un re Þ ¼ RT
v 2 vb
El coeficiente de Joule-Thomson es igual a la pendiente
de las líneas isoentálpica en la Figura 1. En la región donde metro donde la constante un da una medida de las fuerzas
JT < 0, la expansión isoentálpica resulta en un aumento de intermoleculares entre las moléculas, y la constante segundo proporciona
temperatura, mientras que en la región donde metro JT> 0, la una medida del tamaño finito de las moléculas de gas.
expansión respectivo resulta en una disminución de la constantes un
temperatura. La curva que separa las dos regiones se y segundo dependen por lo tanto de la especie y se puede
denomina curva de inversión. El coeficiente de J-T es cero a lo determinar utilizando la primera y segunda derivada de la
largo de la inversión línea isotérmica en el punto crítico.
# 2015 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim
10.1002 / 14356007
2 Joule Thomson-Efecto
La curva de inversión está formado por todos los puntos en los que
el coeficiente de J-T es cero. La temperatura de inversión T yo partir de la
Ecuación 2 viene dada por:
T yo ¼ 2 un re Þ2
bR 1 b = v
La temperatura máxima de inversión para un fluido de van
der Waals es la temperatura en la curva de inversión donde pag
¼ 0 (o b / v ¼ 0) o T i, máx ¼ 2 un / BR. La temperatura de
inversión máxima (en K) para varios gases es la siguiente:
Figura 1. diagrama de temperatura-presión General para un gas real
helio [ 4 Él] 45
Monóxido de carbono 652
Hidrógeno 205
La expresión para el coeficiente de J-T para un gas de van Neón 250
Argón 794
der Waals es dada por la Ecuación 2:
Aire 603
Oxígeno 761
re Þ re
1b=v Þ2 segundo Nitrógeno 621
metro JT ¼ 2 a = marido
RT yo re 2 Þ
Metano 939
do pag 1 re2 = VRT Þ re
1b=v Þ2
Para valores grandes del volumen específico, como ocurre
Las temperaturas máximas de inversión para el helio, el
típicamente en las fases de gas, la ecuación 2 puede aproximarse
hidrógeno, y el neón están por debajo de la temperatura ambiente.
por:
Al comenzar desde la temperatura ambiente, los sistemas de
2 un
licuefacción que utilizan expansión J-T solo para producir baja
metro JT ¼ 1
do pag RT b temperatura no se pueden utilizar para licuar estos gases: medios
adicionales, tales como fuentes externas de motores de
Esta expresión muestra que el J-T refrigeración o de expansión deben ser utilizados con el fin de
coeficiente es positivo cuando T < 2 a / bR y negativo cuando T> licuar estos gases.
2 un / BR.
You might also like
- TopTherm Chiller ManualDocument64 pagesTopTherm Chiller ManualMarceloNo ratings yet
- Equipos Sem AbancayDocument104 pagesEquipos Sem Abancaywilber tica quispeNo ratings yet
- Cubiertas-livianas-semipesadas-pesadasDocument50 pagesCubiertas-livianas-semipesadas-pesadasEnzo75% (8)
- 1.-Valorizacion Formato SetDocument25 pages1.-Valorizacion Formato SetAlvaro NuñezNo ratings yet
- Actividades Finales Tema 6Document4 pagesActividades Finales Tema 6RaquelNo ratings yet
- TFG Orihuela Gracia Aitor-2Document30 pagesTFG Orihuela Gracia Aitor-2JESÚS ERNESTO GARCÍA SÁENZ100% (1)
- NaOH PIIDocument14 pagesNaOH PIIMelany CruzNo ratings yet
- Pavimentos AsfalticosDocument10 pagesPavimentos Asfalticosjarold velezNo ratings yet
- Fundición y Aleaciones Metalicas 1Document311 pagesFundición y Aleaciones Metalicas 1Gilmar Josef Medina Silva100% (1)
- Eficiencia Energética en Sistemas TérmicoDocument11 pagesEficiencia Energética en Sistemas TérmicoJorgeNo ratings yet
- Universidad Tecnológica de Los Andes - Utea AbancayDocument32 pagesUniversidad Tecnológica de Los Andes - Utea AbancaySheila Katheryn Paucar AnccoNo ratings yet
- Concepto Sobre Motor DieselDocument27 pagesConcepto Sobre Motor DieselMaikol OteroNo ratings yet
- Desmontar y Montar El Cartucho de SecadorDocument2 pagesDesmontar y Montar El Cartucho de Secadorpepepin1000No ratings yet
- 4-Teoria de WhitneyDocument19 pages4-Teoria de WhitneyjoseNo ratings yet
- Alfa GRSDocument12 pagesAlfa GRSCompras ArkgrunNo ratings yet
- La Fabrica Inteligente 24-07-2020 - 2Document70 pagesLa Fabrica Inteligente 24-07-2020 - 2Edgar SeguraNo ratings yet
- Planilla de Descripcion de SueloDocument4 pagesPlanilla de Descripcion de Sueloiber rojas choqueNo ratings yet
- Instalaciones sanitarias en edificaciones: Reporte de práctica sobre tuberías PVC y aceroDocument12 pagesInstalaciones sanitarias en edificaciones: Reporte de práctica sobre tuberías PVC y aceroJaviier Abarca MoralesNo ratings yet
- Como se clasifica el papel para poder ser recicladoDocument5 pagesComo se clasifica el papel para poder ser recicladoFernando del ValleNo ratings yet
- Lubekrafft ® Fh-Ep: Aceite para Circuitos Hidráulicos de Alta Presión Tipo HM - HLPDocument2 pagesLubekrafft ® Fh-Ep: Aceite para Circuitos Hidráulicos de Alta Presión Tipo HM - HLPDaniNo ratings yet
- Capítulo C.4 - NSR-10Document10 pagesCapítulo C.4 - NSR-10David TapiasNo ratings yet
- Transformadores de PotenciaDocument38 pagesTransformadores de PotenciaSantiago RoseroNo ratings yet
- Presupuesto de habilitación urbana Viñedos de ConacheDocument4 pagesPresupuesto de habilitación urbana Viñedos de ConacheGERSON VALVERDE RODRIGUEZNo ratings yet
- Memoria de cálculo estructural revisión por cortante y flexión trabe TA.7Document2 pagesMemoria de cálculo estructural revisión por cortante y flexión trabe TA.7Andrés Vidal VargasNo ratings yet
- Ventilación de minas: tipos y clasificación de ventiladoresDocument15 pagesVentilación de minas: tipos y clasificación de ventiladoresDavidColoradoNo ratings yet
- Ejercicios de EngranajesDocument8 pagesEjercicios de EngranajesJairo Manuel Saavedra AcostaNo ratings yet
- Unidad Iv Logistica InversaDocument16 pagesUnidad Iv Logistica Inversahector matosNo ratings yet
- ManualDocument16 pagesManualFreddy Mateo Aragon DelgadoNo ratings yet
- Control de Calidad en Pavimento RigidoDocument6 pagesControl de Calidad en Pavimento RigidoarnoldNo ratings yet
- Datos Del Salar de UyuniDocument2 pagesDatos Del Salar de Uyuninabila8No ratings yet