Professional Documents
Culture Documents
Reacciones Químicas - Practica de Laboratorio
Uploaded by
Robert WilliamsOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Reacciones Químicas - Practica de Laboratorio
Uploaded by
Robert WilliamsCopyright:
Available Formats
PRACTICA DE LABORATORIO N°5
REACCIONES QUIMICAS
1. OBJETIVOS
a) Observar las diferentes Reacciones Químicas
b) Identificar los tipos de reacciones químicas más comunes.
2. MARCO TEÓRICO O PRINCIPIOS TEÓRICOS
REACCIONES QUIMICAS
La materia puede sufrir cambios físicos, químicos y nucleares. Los cambios químicos suceden mediante
las reacciones químicas, y estas se representan mediante las ecuaciones químicas. Las reacciones
químicas suceden a cada segundo y en todo el universo. Las mismas tienen di- versas importancias y
pueden ser de diferentes tipos; estas reacciones suceden en el aire, en el suelo, en los vegetales, en
los animales, en los humanos, en la cocina, en automóviles, etc. Son ejemplos de reacciones químicas
la respiración, la fotosíntesis, el metabolismo, la reproducción, el crecimiento, la formación de óxidos,
de hidróxidos, de ácidos, de sales, de rocas y suelo, etc. Sin embargo, para que se realice una
reacción química es necesaria la presencia de una o más sustancias, para que se descomponga o se
combinen y así formar las o la nueva sustancia.
Tipos de reacciones químicas
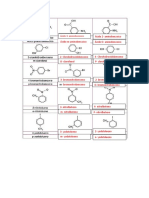
Reacción de síntesis
Elementos o compuestos sencillos se unen para formar un compuesto más complejo.
Formula general
A+B→C
Ejemplo
Na2O(s) + H2O (l) → 2Na (OH) (ac)
Reacción de descomposición
Un compuesto se fragmenta en elementos o compuestos más sencillos.
Formula general
AB → A + B
Ejemplo
2 H2O (l) → 2 H2 (g) + O2 (g)
Reacción de desplazamiento simple
Un elemento reemplaza a otro en un compuesto.
Formula general
AB (ac)+C→A+CB (ac)
Ejemplo
2 NaI + Br2 → 2 NaBr + I2
Reacción de doble desplazamiento
Los iones en un compuesto cambian lugares con los iones de otro compuesto para formar dos sustancias
diferentes.
Formula general
AB + CD → CB + AD
Ejemplos
HCl + NaOH → NaCl + H2O
3. DETALLES EXPERIMENTALES
3.1 materiales y reactivos usados en laboratorio:
Cinta de magnesio, tubo de ensayo, granalla de zinc, sal, ácido clorhídrico,
piseta, anaranjado de metilo.
Procedimiento experimental sobre reacciones químicas:
a) cogemos la lámina de zinc y la echamos dentro de tubo de ensayo y añadimos
el ácido clorhídrico y obtenemos como resultado una efervescencia.
b) cogemos la cinta de magnesio y en otro tubo de ensayo lo introducimos y
nuevamente le añadimos ácido clorhídrico y obtenemos otra efervescencia.
c) en un matraz echamos el carbonato de sodio con ácido clorhídrico y luego
agregamos anaranjada de metilo y se pondrá de color amarillo y por último
agregamos nuevamente ácido clorhídrico para que este cambie a color
anaranjado.
4. TABLA DE REPORTE DE LOS MATERIALES ESTUDIADOS
MATERIALES Descripción IMAGEN
(Resumen breve sobre su uso )
PISETA
Este utensilio facilita la limpieza
de tubos de ensayo, vaso de
precipitados y electrodos. También
son utilizadas para limpiar cristal
esmerilado como juntas o uniones
de vidrio.
También son frascos cerrados con
un tapón atravesado por dos
tubos. Por uno de ellos se sopla,
saliendo agua por el otro. Se
utilizan para enjuagar el material
de laboratorio, ya sea para disolver
o para lavar
AGITADOR Un agitador es un instrumento,
usado en los laboratorios de
química, consiste en una varilla
regularmente de vidrio que sirve
para mezclar o revolver por medio
de la agitación de algunas
sustancias.
ERLENMEYER El matraz de Erlenmeyer es un
frasco de vidrio ampliamente
utilizado en laboratorios
de Química y Física. También es
conocido por los nombres
de frasco de Erlenmeyer, matraz
Erlenmeyer, o
simplemente Erlenmeyer o matraz,
y además como matraz de síntesis
extrema de químicos.
TUBO DE ENSAYO El tubo de ensayo es parte
del material de vidrio de un
laboratorio de química. Consiste
en un pequeño tubo cilíndrico de
vidrio con un extremo abierto (que
puede poseer una tapa) y el otro
cerrado y redondeado, que se
utiliza en los laboratorios para
contener pequeñas muestras
líquidas o sólidas, aunque pueden
tener otras fases, como
realizar reacciones químicas en
pequeña escala. Entre ellos está el
exponer a temperatura el mismo
contenedor. Se guardan en un
instrumento
de laboratorio llamado gradilla.
BALANZA Una balanza de laboratorio va a
permitir medir la masa de un
cuerpo o sustancia química, por
medio de la comparación de fuerza
que ejerce la gravedad que actúa
sobre un determinado cuerpo.
Simplemente para obtener el peso
de cualquier sustancia.
SOPORTE UNIVERSAL Un soporte de laboratorio, soporte
universal es una pieza del
equipamiento de laboratorio
donde se sujetan las pinzas de
laboratorio, mediante dobles
nueces.
PLACA DE PETRI La placa de Petri es un recipiente
redondo, de cristal o plástico, con
una cubierta de la misma forma
que la placa, pero algo más grande
de diámetro, para que se pueda
colocar encima y cerrar el
recipiente, aunque no de forma
hermética.
BICARBONATO DE es un compuesto sólido cristalino
SODIO de color blanco soluble en agua,
con un ligero
sabor alcalino parecido al
del carbonato de sodio de
fórmula NaHCO3. Se puede
encontrar como mineral en la
naturaleza o se puede producir
artificialmente.
CINTA DE MAGNESIO La combustión de la cinta de
magnesio es una reacción que
aparte de ser exotérmica (libera
energía) produce una gran
cantidad de luz, como producto se
forma oxido de magnesio, que es
un polvo blanco.
PIPETA La pipeta es un instrumento
volumétrico de laboratorio que
permite medir la alícuota de un
líquido con mucha precisión.
Suelen ser de vidrio o plástico.
Límites de error en pipetas (ml)
Capacidad Límite de
(hasta) error
2 0,006
5 0,01
10 0,02
30 0,03
50 0,05
100 0,08
200 0,10
ACIDO MURIATICO El ácido clorhídrico, ácido
muriático, espíritu de sal, ácido
marino, ácido de sal o todavía
ocasionalmente llamado, ácido
hidroclórico, agua fuerte o
salfumán, es una disolución acuosa
del gas cloruro de hidrógeno. Es
muy corrosivo y ácido
5. CONCLUSIONES
En conclusión, se puedes decir que las reacciones químicas son de gran importancia ya que son
fenómenos que vemos a diario en nuestra vida y son la base de la realización de las funciones vitales y
las demás actividades del hombre o cualquier otro ser vivo, como por ejemplo la respiración es una
reacción química, ya que al organismo entra O2 y sale CO2. Además todas las sustancias que usamos o
usan los demás seres vivos fueron producto de reacciones químicas.
Existen varios tipos de reacciones los cuales son: reacción de combinación, de descomposición, de
sustitución y de doble sustitución, todos estos muy diferentes pero cumplen la misma función la
formación de uno o varias sustancias y/o compuestos nuevos, los cuales pueden ser de mucha utilidad,
o también pueden ser dañinos para la naturaleza.
Como fue de esperar pudimos comprobar que toda la teoría que sabíamos y estudiamos, se cumple en
la vida, ya que todas las reacciones según su tipo se comportaron como dicen nuestras lecturas y las
personas que conocen el tema, lo cual nos ha permitido reconocer y diferenciar bien los tipos de
reacciones químicas.
6. RECOMENDACIONES
El uso de bata es obligatorio, deberá estar siempre cerrada y no ser utilizada fuera del laboratorio. Se
recomienda llevar zapatos cerrados y no sandalias. Se utilizarán guantes para protección de las manos.
El pelo largo deberá estar siempre recogido. Se evitará el uso de anillos, pulseras. Es preciso no hacer
bromas, correr, jugar, empujar o gritar en el laboratorio.
7. CUESTIONARIO
1-Clasifica cada una de las reacciones
a.-2KBr +Cl2 --------------------------- 2KCl + Br2
(Desplazamiento simple)
b-NaF + AgNO3 -------------------------- AgF +NaNO3
(Desplazamiento doble)
c.-BaCl2 +H2SO4 ----------------------- BaSO4 + 2HCl
(Desplazamiento doble)
d.-2NaHCO3 ------------------------- Na2CO3 +CO 2+ H2O
(combustión)
e.- 2HNO3 +3H2S ------------------------- 2NO + 3 S + 4 H2O
(Combustión)
2.-Completa las siguientes reacciones.
a.- 2KBr + Cl2 ………………….. 2KCl + Br2
b- CaCl2 + HSO4 ………………….. CaSO4 + HCl
2.-ELABORA TUS CONCLUSIONES
En síntesis podemos decir que las reacciones químicas son de suma importancia ya
que son fenómenos que vemos a diario en nuestra vida y son la base de la realización
de las funciones vitales y las demás actividades del hombre o cualquier otro ser vivo.
Como por ejemplo la respiración es una reacción química, ya que al organismo entra
O2 y sale CO2.
Además todas las sustancias que usamos o usan los demás seres vivos fueron producto de
reacciones químicas.
8. REFERENCIAS BIBLIOGRÁFICAS
1.- T.L. BROWN, H.E. LEMAY y B.E. BURSTEN. Química: la ciencia central. Prentice-Hall. – 7ª
edición (1998)
2.- R.W. WHITTEN, R.E. DAVIS, M.L. PECK. Química General. Mac Graw-Hill Interamericana de España.
5ª edición (1998)
3.- B.M. MAHAN y R.J. MYERS. Química: curso universitario. Addison-Wesley Iberoamericana. – 4ª
edición (1990)
4. www.wikipedia.com (Enciclopedia Libre)
You might also like
- Informe de Laboratorio - Tipos de ReaccionesDocument31 pagesInforme de Laboratorio - Tipos de ReaccionesViictor E VergaraNo ratings yet
- Laboratorio 1 Instalacion Equipo de Aire Acondicionado (Terminado)Document34 pagesLaboratorio 1 Instalacion Equipo de Aire Acondicionado (Terminado)ANGEL CORDOVANo ratings yet
- Sarta de PerforacionDocument37 pagesSarta de PerforacionAngel Perez GomezNo ratings yet
- Reactivos de Flotacion 2023Document56 pagesReactivos de Flotacion 2023Dario100% (1)
- Informe de Química 3 - UnasamDocument21 pagesInforme de Química 3 - UnasamJosé IvañezNo ratings yet
- AmidasDocument21 pagesAmidasAngel LuisNo ratings yet
- Informe EstequiometriaDocument18 pagesInforme EstequiometriaXiomara JorgaNo ratings yet
- Alcoholes y FenolesDocument14 pagesAlcoholes y Fenolesbryanmateo50% (2)
- Diferencia Entre Compuestos Organicos e InorganicosDocument11 pagesDiferencia Entre Compuestos Organicos e InorganicosWendy Faroni Cruz Valverde100% (1)
- Ecuacion de Bernoulli para FluidosDocument56 pagesEcuacion de Bernoulli para FluidosClaudio Rosas PérezNo ratings yet
- Hid Ro Carb UrosDocument7 pagesHid Ro Carb UrosTANIA DAMARIS CABRERA SALASNo ratings yet
- Analisis ConformacionalDocument44 pagesAnalisis ConformacionalRicardo Alcántara ReyesNo ratings yet
- Q.o-Practica de HidrocarburosDocument9 pagesQ.o-Practica de HidrocarburosMARIA FERNANDA LLERENA VALDIVIANo ratings yet
- Canalizaciones Electricas Normalizadas Segun El Codigo Electrico NacionalDocument105 pagesCanalizaciones Electricas Normalizadas Segun El Codigo Electrico NacionalajlarezNo ratings yet
- Eval Aux CaDocument1,176 pagesEval Aux CaCarlo Alberto Jimenez AriesNo ratings yet
- Enlaces QuimicosDocument16 pagesEnlaces QuimicosAngie Lea Herrera0% (1)
- Informe Acidos CarboxilicosDocument8 pagesInforme Acidos CarboxilicosJesus VitarNo ratings yet
- Ensayo A La LlamaDocument4 pagesEnsayo A La LlamaChristopher Daniel Enrique Sotelo NestarezNo ratings yet
- Ley Boyle resumenDocument2 pagesLey Boyle resumenvictorNo ratings yet
- Cuestionario Equilibrio Químico y PHDocument8 pagesCuestionario Equilibrio Químico y PHisaNo ratings yet
- Guía 4. EstequiometríaDocument9 pagesGuía 4. Estequiometríajesney morenoNo ratings yet
- Acidos CarboxilicosDocument76 pagesAcidos CarboxilicoshelloNo ratings yet
- Reactividad de MetalesDocument7 pagesReactividad de MetalesKarla Valderrama CardozoNo ratings yet
- Unidad II. Quimica de Los Elementos RepresentativosDocument36 pagesUnidad II. Quimica de Los Elementos RepresentativosMimi TorresNo ratings yet
- Práctica 2A Punto de EbulliciónDocument17 pagesPráctica 2A Punto de Ebulliciónmaria alexis de leon archilaNo ratings yet
- Combustion y Ensayos A La LlamaDocument7 pagesCombustion y Ensayos A La LlamaDavid Diaz CapitanNo ratings yet
- Propiedades Físicas y Químicas de Los Ácidos CarboxílicosDocument11 pagesPropiedades Físicas y Químicas de Los Ácidos CarboxílicosFernanda Mateus100% (1)
- Tipos de Reaccion QuimicaDocument9 pagesTipos de Reaccion QuimicaJiress Joseph Santiago Flórez0% (1)
- Sustitución Electrofílica Aromática-Química Órganica IIDocument7 pagesSustitución Electrofílica Aromática-Química Órganica IISOFIA ALEJANDRA ZAMORA VALIENTE100% (1)
- Reacciones QuimicasDocument84 pagesReacciones QuimicasEnrique MadrigalNo ratings yet
- Examen Quimica Organica Avanzada UcmDocument5 pagesExamen Quimica Organica Avanzada UcmÁlvarol_61No ratings yet
- Globo Resistente Al FuegoDocument3 pagesGlobo Resistente Al FuegoKENDRIS SOFIA VELILLA BARCELONANo ratings yet
- Grupo 15 PnicogenosDocument11 pagesGrupo 15 PnicogenosGeogeneralNo ratings yet
- Quimica Hidrocarburos Aromaticos Guia 2Document3 pagesQuimica Hidrocarburos Aromaticos Guia 2Ricardo AndresNo ratings yet
- Informe Reacciones de AlcoholesDocument6 pagesInforme Reacciones de AlcoholesDaniel Buendia100% (1)
- FUNCIONES QUIMICAS InformeDocument4 pagesFUNCIONES QUIMICAS InformeLucero Violeta0% (1)
- Practica 4 Quimica Rodriguez Herrera, Erick Ceyler.Document7 pagesPractica 4 Quimica Rodriguez Herrera, Erick Ceyler.Erick Rodriguez HerreraNo ratings yet
- Obtención de óxidos básicos e hidróxidosDocument22 pagesObtención de óxidos básicos e hidróxidosDina Orozco LópezNo ratings yet
- Análisis Elemental OrgánicoDocument6 pagesAnálisis Elemental OrgánicoOsvarcha AchravsoNo ratings yet
- Identificación de Colores A La FlamaDocument7 pagesIdentificación de Colores A La FlamaYara AragónNo ratings yet
- Parcial AminasDocument12 pagesParcial AminasJohaAlvarez0% (1)
- Cuestionarios Del Informe 1Document2 pagesCuestionarios Del Informe 1Shirley UlloaNo ratings yet
- Practica #8 QuimicaDocument7 pagesPractica #8 QuimicaJorge MartinezNo ratings yet
- Informe AminasDocument15 pagesInforme AminasKriss CastilloNo ratings yet
- Hidrocarburos Cíclicos y AromáticosDocument6 pagesHidrocarburos Cíclicos y AromáticosYJPT 111005No ratings yet
- Aldehidos y Cetonas Primera ParteDocument34 pagesAldehidos y Cetonas Primera PartePaolaAlejandraRodriguezNo ratings yet
- Punto de Ebullicion CorregidoDocument11 pagesPunto de Ebullicion CorregidoSabrina PestanaNo ratings yet
- A4 Portada de Propuesta de Proyecto Científico Infantil Doodle Violeta y BlancoDocument24 pagesA4 Portada de Propuesta de Proyecto Científico Infantil Doodle Violeta y BlancoDafne Flores MendozaNo ratings yet
- Punto TripleDocument5 pagesPunto TripleRosalino Mayoral LagunesNo ratings yet
- Informe 6Document6 pagesInforme 6daniellgb96No ratings yet
- Obtención alcoholes métodos principalesDocument2 pagesObtención alcoholes métodos principalesParedes Diaz Erix0% (1)
- Sustitución Nucleofílica UnimolecularDocument5 pagesSustitución Nucleofílica UnimolecularGänon AbrahamNo ratings yet
- EscandioDocument6 pagesEscandioSUGEY HEYDI CALLO HUANACONo ratings yet
- Laboratorio de ácidos carboxílicos UDES 2020Document20 pagesLaboratorio de ácidos carboxílicos UDES 2020andrea carolina suárez bolañoNo ratings yet
- Nomenclatura Quimica PDFDocument32 pagesNomenclatura Quimica PDFBravo Stg YeraNo ratings yet
- Práctica 05 - OXIDACIÓN Y SUSTITUCIÓN DE COMPLEJOS DE COBALTO - IIDocument2 pagesPráctica 05 - OXIDACIÓN Y SUSTITUCIÓN DE COMPLEJOS DE COBALTO - IIAlex IsNo ratings yet
- Prueba LucasDocument5 pagesPrueba Lucasadriana quinteroNo ratings yet
- Atmósfera: capas y composiciónDocument121 pagesAtmósfera: capas y composiciónDeydaraTorresNo ratings yet
- Importancia de La Quimica en Nuestra Vida CotidianaDocument3 pagesImportancia de La Quimica en Nuestra Vida CotidianaTabata HernandezNo ratings yet
- Desastre Bhopal Muerte QuimicaDocument29 pagesDesastre Bhopal Muerte QuimicaDiegoMiguelTamaraMori100% (1)
- Aldehidos y Cetonas PracticaDocument20 pagesAldehidos y Cetonas PracticaAnonymous 2LFdJ7ATHwNo ratings yet
- Practica 2 Quimica Organica I REACTIVIDAD Y CARACTERIZACIÓN DE HIDROCARBUROSDocument5 pagesPractica 2 Quimica Organica I REACTIVIDAD Y CARACTERIZACIÓN DE HIDROCARBUROSJeison ArguelloNo ratings yet
- Practica de Laboratorio N 6Document7 pagesPractica de Laboratorio N 6Robert WilliamsNo ratings yet
- GUÍA DE LABORATORIO Nº 1Document14 pagesGUÍA DE LABORATORIO Nº 1Samuel Rojas AraujoNo ratings yet
- Informe de Laboratorio de Tipos de ReaccionesDocument39 pagesInforme de Laboratorio de Tipos de Reaccionescelso100% (1)
- Actividad SESION 14 - Teoría de RestriccionesDocument1 pageActividad SESION 14 - Teoría de RestriccionesRobert WilliamsNo ratings yet
- Actividad SESION 9 Ejercicios CapacidadDocument1 pageActividad SESION 9 Ejercicios CapacidadRobert WilliamsNo ratings yet
- Actividad SESION 13 - Asignación de CargasDocument1 pageActividad SESION 13 - Asignación de CargasRobert WilliamsNo ratings yet
- Actividad SESION 7 Ejercicio MRPDocument1 pageActividad SESION 7 Ejercicio MRPRobert WilliamsNo ratings yet
- Actividad SESION 9 Ejercicios CapacidadDocument1 pageActividad SESION 9 Ejercicios CapacidadRobert WilliamsNo ratings yet
- Interés SimpleDocument38 pagesInterés SimpleRobert WilliamsNo ratings yet
- Actividad SESION 2 Pronósticos en Adm. de OperacionesDocument1 pageActividad SESION 2 Pronósticos en Adm. de OperacionesRobert Williams100% (1)
- Actividad SESION 3 Administración de InventariosDocument1 pageActividad SESION 3 Administración de InventariosAnthony MerinoNo ratings yet
- Cuello de BotellaDocument1 pageCuello de BotellaRobert WilliamsNo ratings yet
- Actividad SESION 7 Ejercicio MRPDocument1 pageActividad SESION 7 Ejercicio MRPRobert WilliamsNo ratings yet
- Interes CompuestoDocument3 pagesInteres CompuestoRobert Williams0% (1)
- PDFDocument23 pagesPDFLEWIS144000No ratings yet
- Cuello de BotellaDocument1 pageCuello de BotellaRobert WilliamsNo ratings yet
- Método KaizenDocument1 pageMétodo KaizenRobert WilliamsNo ratings yet
- Perfil Laboral: Identifica tus CapacidadesDocument13 pagesPerfil Laboral: Identifica tus CapacidadesRobert WilliamsNo ratings yet
- Content 2Document2 pagesContent 2Robert WilliamsNo ratings yet
- Interes CompuestoDocument3 pagesInteres CompuestoRobert Williams0% (1)
- Artículo Transporte y LogísticaDocument5 pagesArtículo Transporte y LogísticaHaider BALLEN PELAYONo ratings yet
- Segunda Tarea PersonalDocument4 pagesSegunda Tarea PersonalRobert WilliamsNo ratings yet
- 179420763002Document12 pages179420763002Danny GudielNo ratings yet
- Interés Compuesto GrupalDocument5 pagesInterés Compuesto GrupalRobert WilliamsNo ratings yet
- El Vínculo Entre La Logística y El Desarrollo de Un PaísDocument7 pagesEl Vínculo Entre La Logística y El Desarrollo de Un PaísRobert WilliamsNo ratings yet
- Articulo de Opinion GCSDocument3 pagesArticulo de Opinion GCSRobert WilliamsNo ratings yet
- Utf 8''sesion1Document3 pagesUtf 8''sesion1Robert WilliamsNo ratings yet
- Ejercicios Aplicativos de UnitarizacionDocument3 pagesEjercicios Aplicativos de UnitarizacionRobert WilliamsNo ratings yet
- TrabajoDocument1 pageTrabajoRobert WilliamsNo ratings yet
- Ejercicios Aplicativos de UnitarizacionDocument3 pagesEjercicios Aplicativos de UnitarizacionRobert WilliamsNo ratings yet
- Avance Articulo de OpiniónDocument6 pagesAvance Articulo de OpiniónRobert WilliamsNo ratings yet
- Administración Logística - Introducción IIDocument14 pagesAdministración Logística - Introducción IIRobert WilliamsNo ratings yet
- Sistema Pull y OushDocument2 pagesSistema Pull y OushRobert WilliamsNo ratings yet
- Información Técnica RP-6 Primario Epóxico Con PoliamidasDocument2 pagesInformación Técnica RP-6 Primario Epóxico Con Poliamidasalexis morales espinozaNo ratings yet
- Helico: PracticeDocument4 pagesHelico: PracticePaul CRNo ratings yet
- Grupo 1 Cuestionario No. 3Document5 pagesGrupo 1 Cuestionario No. 3Hector Octavio Guerrero FloresNo ratings yet
- Intalacion de Sello de Labio Caterpillar 3516Document9 pagesIntalacion de Sello de Labio Caterpillar 3516felixNo ratings yet
- Estructuras 1s2Document6 pagesEstructuras 1s2Alexis BarreraNo ratings yet
- Reacciones de ANIONES PDFDocument4 pagesReacciones de ANIONES PDFMilagros JofreNo ratings yet
- Evolución de Envases de La Marca AlicorpDocument10 pagesEvolución de Envases de La Marca AlicorpRonaldNo ratings yet
- Resolucion 1265 - CPS - 2003Document13 pagesResolucion 1265 - CPS - 2003fenixtucuNo ratings yet
- Ejercicios Mezclados-2Document4 pagesEjercicios Mezclados-2Jampier Santillan CabreraNo ratings yet
- Informe Quimica 5.3 5.4Document7 pagesInforme Quimica 5.3 5.4Rodrigo Gutiérrez MedinaNo ratings yet
- INSUMOSDocument18 pagesINSUMOSErnestoAlejandroPinedaRamirezNo ratings yet
- Clasificacion de Los Aceros InoxidablesDocument5 pagesClasificacion de Los Aceros InoxidablesYoisiNo ratings yet
- DeWalt - Ficha Tecnica Epoxico Pure220+ (ESP)Document21 pagesDeWalt - Ficha Tecnica Epoxico Pure220+ (ESP)Jorge Luis MontesNo ratings yet
- Materiales de vidrio y porcelana para laboratorio de químicaDocument4 pagesMateriales de vidrio y porcelana para laboratorio de químicajhanrata0% (1)
- Ficha Tecnica SUB-1500KVA-13200D-ALALDocument1 pageFicha Tecnica SUB-1500KVA-13200D-ALALoareyna.ccNo ratings yet
- Quimica Organica y BiologicaDocument202 pagesQuimica Organica y BiologicaAL ServiciosGraficosNo ratings yet
- Guía didáctica sobre estructura atómicaDocument16 pagesGuía didáctica sobre estructura atómicaJavier SuarezNo ratings yet
- Propiedades Fisicas de Los Materiales - 1Document2 pagesPropiedades Fisicas de Los Materiales - 1Juan LopezNo ratings yet
- Alcohol en gel 70% seguridadDocument1 pageAlcohol en gel 70% seguridadSA NinatantaNo ratings yet
- Resumen 11Document3 pagesResumen 11Jhon AlvarezNo ratings yet
- Modelos de PortadasDocument3 pagesModelos de PortadasRaul LacaveNo ratings yet
- Guia de Ejercicios de SolucionesDocument2 pagesGuia de Ejercicios de SolucionesanaNo ratings yet
- Cuadro ComparativoDocument2 pagesCuadro ComparativoSantiago EscorzaNo ratings yet
- Carbon VegetalDocument5 pagesCarbon VegetalNoely NCNo ratings yet
- Corrosión de Metales y Protección con RecubrimientosDocument3 pagesCorrosión de Metales y Protección con RecubrimientosAnthony JorgeNo ratings yet