Professional Documents
Culture Documents
Coloraci N de Gram
Uploaded by
Elias Antanas Muñoz NeyraOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Coloraci N de Gram
Uploaded by
Elias Antanas Muñoz NeyraCopyright:
Available Formats
COLORACIN DE GRAM Beatriz Salazar Giraldo La coloracin de Gram es una tincin diferencial usada para clasificar las bacterias
de acuerdo a su forma, tamao morfologa celular y afinidad tintorial de la pared celular. Es adicionalmente una prueba empleada para el diagnstico presuntivo de agentes infecciosos y para la evaluacin de la calidad de especimenes clnicos. La coloracin fue desarrollada por Christian Gram en 1884. La modificacin realizada por Hucker en 1921 es la actualmente usada ya que provee mayor estabilidad a los reactivos y mejor diferenciacin de los microorganismos. La modificacin de Kopeloff es til para colorear anaerobios y para organismos que se tien dbilmente Gram negativos como Legionella spp, Campylobacter spp, Brucella spp y otros y se usa carbol fuscina o fuscina bsica como contraste. PRINCIPIO La clula bacteriana intacta se tie fcilmente con colorantes bsicos como cristal violeta, azul de metileno y fuscina bsica pero tie pobremente con colorantes cidos como la eosina. Debido a la carencia de envoltura nuclear en las clulas procariticas, el protoplasma bacteriano es cido por contener grandes cantidades de cidos nucleicos presentando una marcada afinidad por los colorantes bsicos. Las bacterias pueden se coloreadas como Gram positivas o Gram negativas de acuerdo con las diferencias en la composicin de la pared celular. Las bacterias Gram positivas tienen una gruesa capa de peptidoglicano y una gran cantidad de cidos teicoicos, ellas no son afectadas por la decoloracin con alcohol y retienen su coloracin inicial. Las bacterias Gram negativas tienen una sola capa de peptidoglicano unida a una bicapa compuesta por protenas fosfolpidos y lipoprotenas la cual es disuelta y decolorada con el alcohol removiendo el complejo cristal violeta-lugol y reemplazando el color con el colorante de contraste. APECTOS QUE PUEDEN MODIFICARLA Presencia de sustancias inhibidoras Edad del cultivo Tipo de medio de cultivo Atmsfera de incubacin Presencia de fagocitos en las muestras Tratamientos previos establecidos en el paciente
PROPOSITOS Observar la presencia, y cantidad de leucocitos presentes en la muestra que indican la magnitud y el tipo de respuesta inflamatoria Corroborar la calidad de algunas muestras para determinar si se acepta o no para su procesamiento Determinar la presencia y cantidad de bacterias as como su morfologa y agrupacin caractersticas Determinar la afinidad tintorial de las bacterias observadas
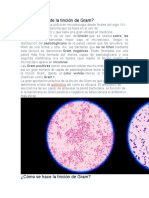
PROCEDIMIENTO El frotis debe ser lo suficientemente grueso de tal manera que cada campo microscpico contenga algunos elementos morfolgicos identificables, pero no tan grueso que las clulas queden superpuestas. Se deja que el frotis se seque al aire y luego debe fijarse con calentamiento lento (una o dos pases por la llama sin que la placa se caliente demasiado), tambin puede colocarse sobre una plancha elctrica o con 0.5 ml de metanol sobre la preparacin hasta que se evapore, una vez fijada se procede a colorear de la siguiente forma: Cubrir la preparacin con solucin de cristal violeta 30 seg Lavar con agua corriente agregar la solucin de lugol por 30 seg lavar con agua corriente decolorar con alcohol acetona por 1 a 5 seg lavar con agua corriente agregar la solucin de safranina por 30 seg lavar con agua corriente dejar secar observar al microscopio con objetivo de inmersin (100X)
INTERPRETACIN El nmero de clulas y de bacterias se debe determinar promediando 20 a 40 campos microscpicos.
Recuento de clulas se expresa as: 1+: (raras, ocasionales) menos de 1 por campo de bajo poder 2+: (pocos) de 1 a 9 por campo de bajo poder 3+:(moderado) 10 a 25 por campo de bajo poder 4+:(abundantes) > de 25 por campo de bajo poder El recuento de microorganismos se realiza as: 1+: (raros, ocasionales) menos de 1 por campo de inmersin 2+:(pocos) 1 a 5 por campo de inmersin 3+: (moderado) 6 a 30 por campo de inmersin 4+: (muchos o numerosos) >30 CONTROL DE CALIDAD A. Chequear la apariencia de los reactivos diariamente: Si el cristal violeta esta precipitado o presenta sedimento se debe refiltrar antes de usar. La evaporacin puede afectar los reactivos . Las soluciones de trabajo deben ser cambiadas regularmente de forma ideal antes de que se agoten en el envase o antes de un mes. Recordar que los colorantes deben ser almacenados en frascos ambar y a temperatura menor a 30C B. Cuando se usa un nuevo lote se debe realizar preparaciones semanales con E. coli (ATCC 25922) y S. epidermidis (ATCC 25923) fijarlas y realizar coloracin de Gram C. Cuando las placas son difciles de interpretar o se observa una tincin deficiente (Gram positivos poco coloreados, Gram negativos coloreados con violeta, placa teida solo en los extremos) es posible que se deba a la preparacin de la muestra, a los reactivos o al procedimiento siendo las siguientes las causas mas comunes: uso de portaobjetos sucios o engrasados, preparaciones muy gruesas, sobrecalentamiento de las placas cuando se fijan, exceso de lavado durante la tincin y precipitacin de los reactivos D. Para asegurar la uniformidad en la interpretacin debe establecerse un sistema para revisar los informes comparando los resultados de los cultivos con los hallazgos del Gram. La morfologa anotada en el directo debe ser recuperada en el cultivo y similarmente los microorganismos obtenidos en los cultivos y que no se observaron al Gram exigen una revisin del directo y los cultivos. Debe recordarse que no todas las bacterias observadas al Gram pueden ser cultivadas. Es apropiado adems tener una caja de coleccin referencia para la comparacin LIMITACIONES: 1. Los resultados del Gram deben ser interpretados en conjunto con otros resultados clnicos y de laboratorio. Otros procedimientos pueden ser requeridos como coloraciones y medios especficos para confirmar los resultados obtenidos a partir del Gram
2. La visualizacin o no de bacterias Gram positivas o Gram negativas puede ser el resultado de una contaminacin de los reactivos o de otros materiales empleados, de la presencia o no de agentes antimicrobianos que impidan visualizarlas o de fallas en el crecimiento de muchos microorganismos en los medios de cultivo usuales 3. Resultados falsos Gram negativos pueden ser ocasionados por inadecuada recoleccin del Espcimen BIBLIOGRAFIA: Alvarez GL, Alzate LM, Jaramillo GU, Restrepo GE, Vasquez ME. Manual de laboratorio de Bacteriologia. Facultad de Medicina, Universidad de Antioquia. 1986. York MK. Aerobic Bacteriology. In: Isemberg HD editor. Clinical Microbiology Procedures Handbook. 2nd ed.Washington, D.C: ASM Press; 2004 p. 3.2-3.2.2.4. Madigan MT, Martinko JM, Parker J editors. Brock Bology of Microorganism. 9th ed. Upper Saddle River, NJ:Prentice Hall;1997. Murray PR, Rosenthal KS, Kobayashi GS, Pfaller MA. Medical Microbiology.3rd ed. St Louis, Missouri: Mosby, Inc; 1998
Tabla 1: MODIFICACIONES DE LA COLORACIN DE GRAM Hucker Reactivos Tiemp o cristal violeta 30 seg yodo de Gram alcohl acetona safranina Bacteriologa general 30 seg 1-5 seg 30 seg Carbol fuscina Reactivos Tiempo cristal violeta yodo de Gram 95% de etanol carbol fuscina o 0.8% de fuscina bsica Bacteroides spp Fusobacteriu m spp Legionella spp Campylobact er spp Brucella spp 30 seg 30 seg 30 seg >o igual a 1 min Kopeloff Reactivos Tiempo cristal 2-3 min violeta alcalino yodo de > o igual a 2 Kopeloff min Alcohl lavar acetona inmediatamente safranina 10 a 30 seg de Kopeloff Otros anaerobios y diagnstico de Vaginosis bacteriana
COLORACIN Coloracin inicial yodo Decolorante Contraste Recomendaciones
Traducido de Clinical Microbiology Procedures Handbook. 2004 p 3.2.1.7
Tabla 2: CARACTERSTICAS DE LA MEMBRANA DE LAS BACTERIAS G(+) Y G (-) CARACTERISTICA Otra membrana Pared celular lipopolisacarido Endotoxina Acidos Teicoicos Esporulacion Capsula lisozima sensibilida a penicilina produccin de exotoxina GRAM (+) ausente Gruesa ausente ausente frecuentemente presentes algunas algunas sensible muchas susceptibles algunas GRAM (-) presente delgada presente presente ausentes ninguna algunas resistente mas resistente algunas
Modificada de Medical Microbiology:1998. p 14
ANEXOS Fig 1: PARED CELULAR GRAM POSITIVA
Fig 2: PARED CELULAR GRAM NEGATIVA
Fig 3: MORFOLOGIAS CELULARES
Fig 4: PASOS PARA REALIZAR LA COLORACIN DE GRAM
Fig 5: DIFERENCIAS EN LA DISPOSICIN DEL PEPTIDOGLICANO EN G(+) Y G (-)
PREGUNTAS 1. Todas las bacterias se colorean con la coloracin de Gram? mencione algunos ejemplos 2. De que manera las diferencias entre las paredes celulares Gram negativas y Gram positivas influencian la supervivencia en el ambiente, las posibilidades de deteccin por el laboratorio y el tratamiento de muchas bacterias? 3. Porqu las esporas son mas resistentes a las condiciones ambientales? 4. Porqu el alcohol rpidamente decolora las bacterias Gram negativas? 5. Enumere las funciones de la otra membrana de los Gram negativos? 6. Explique en trminos qumicos como se forma la capa de peptidoglicano en las bacterias?
You might also like
- Dominando las Tinciones: Manual para el Laboratorio MicrobiológicoFrom EverandDominando las Tinciones: Manual para el Laboratorio MicrobiológicoNo ratings yet
- El cianuro en la minería. Efectos sobre las plantas acuaticasFrom EverandEl cianuro en la minería. Efectos sobre las plantas acuaticasNo ratings yet
- Lab Coloracion GramDocument7 pagesLab Coloracion GramMabel MartínezNo ratings yet
- TINCION GRAM BACTERIASDocument5 pagesTINCION GRAM BACTERIASGESLY MARIANA FIGUEROA OCAMPONo ratings yet
- Coloraciones bacterianas Gram y Ziehl-NeelsenDocument5 pagesColoraciones bacterianas Gram y Ziehl-NeelsenEmilio MurciaNo ratings yet
- Informe de Tincion de GramDocument11 pagesInforme de Tincion de GramIvonne PambabayNo ratings yet
- Afinidad TintorialDocument8 pagesAfinidad Tintorialblais001No ratings yet
- Laboratorio-Técnicas de Tinción2Document5 pagesLaboratorio-Técnicas de Tinción2camilaleguizamon123No ratings yet
- Práctica 5 Tinción de GramDocument4 pagesPráctica 5 Tinción de Gramhlopez169No ratings yet
- Practica N3Document13 pagesPractica N3Helen PolancoNo ratings yet
- Caracterización de Bacterias Gram Positivas y Gram NegativasDocument6 pagesCaracterización de Bacterias Gram Positivas y Gram NegativasLUIS KEVIN GRAJALES NUÑEZNo ratings yet
- Manual de Tecnicas de ColoracionesDocument22 pagesManual de Tecnicas de ColoracionesYolys Salcedo RamirezNo ratings yet
- Informe Microbiologia 3 Aldo IvanDocument8 pagesInforme Microbiologia 3 Aldo IvanaquispeumNo ratings yet
- Reconocimiento de Bacterias Por TinciónDocument8 pagesReconocimiento de Bacterias Por TinciónAnonymous XyqfQFLrNo ratings yet
- Guia Trabajo Práctico N°2 Biol150 2022Document13 pagesGuia Trabajo Práctico N°2 Biol150 2022Denisse nuñezNo ratings yet
- Informe Lab 2 PDFDocument10 pagesInforme Lab 2 PDFBryanDuqueÁlvarezNo ratings yet
- Colorantes y ColoracionesDocument5 pagesColorantes y Coloracionesaracely vasquezNo ratings yet
- Preguntas de Investigación TincionesDocument3 pagesPreguntas de Investigación TincionesLaura Carmona.No ratings yet
- Coloración de Gram y otras especiales para identificación bacterianaDocument5 pagesColoración de Gram y otras especiales para identificación bacterianaLeidy Lorena Aricapa TrujilloNo ratings yet
- Morfología y coloración Gram de bacteriasDocument5 pagesMorfología y coloración Gram de bacteriasDaylin Falcon MalquiNo ratings yet
- Tinción de Gram microbiología UNALDocument3 pagesTinción de Gram microbiología UNALAdriana ToscanNo ratings yet
- Pruebas BacteriologicasDocument12 pagesPruebas BacteriologicasTemplarios 16No ratings yet
- Coloración - MicrobiologíaDocument9 pagesColoración - MicrobiologíaFernando SkNo ratings yet
- Informe de ColoracionesDocument11 pagesInforme de ColoracionesErika BoniNo ratings yet
- Colorantes y Coloraciones Semana 6Document6 pagesColorantes y Coloraciones Semana 6JOSE DAVID IRIGOIN CAMPOSNo ratings yet
- Practica 3 de Microbiologia AnimalDocument11 pagesPractica 3 de Microbiologia AnimalJherson Guillermo Bonifacio EspinozaNo ratings yet
- Practica #2 Tincion Diferencial y SimpleDocument18 pagesPractica #2 Tincion Diferencial y SimpleAnonymous 4QwqDhLRrR100% (1)
- Informe Lab. Tinción de GramDocument16 pagesInforme Lab. Tinción de Gramdavid gonzalezNo ratings yet
- Tincion 1Document19 pagesTincion 1jhoanaporras100% (1)
- Bacterias Coloracion Gram YougurtDocument6 pagesBacterias Coloracion Gram Yougurtvanessa461816100% (1)
- Informe-7-Microbiología OficialDocument8 pagesInforme-7-Microbiología OficialRay Rodriguez HuamanNo ratings yet
- Tinción ácido-resistente microbiologíaDocument8 pagesTinción ácido-resistente microbiologíaChristian SeguraNo ratings yet
- Informe #3 Microbiología Sedimentación y Coloración de GramDocument5 pagesInforme #3 Microbiología Sedimentación y Coloración de Gramyenny lorena trujillo trujilloNo ratings yet
- Examen DirectoDocument22 pagesExamen DirectoMARÍA ALEJANDRA SUÁREZ REMOLINANo ratings yet
- Guia No 6 Observación y Reconocimiento de Células Procariotas PDFDocument10 pagesGuia No 6 Observación y Reconocimiento de Células Procariotas PDFAndzhiita SaampeerNo ratings yet
- Tincion de Gram - CarolinaDocument6 pagesTincion de Gram - CarolinaAndres Ardila MartinezNo ratings yet
- Tincion Gram BacteriasDocument7 pagesTincion Gram BacteriasRudy Strongman PeruNo ratings yet
- Aislamiento Selectivo y Diferencial de MicroorganismosDocument12 pagesAislamiento Selectivo y Diferencial de Microorganismosdiego 1615No ratings yet
- Guía de Laboratorio #10. Tincion DiferencialDocument3 pagesGuía de Laboratorio #10. Tincion DiferencialMaría José De La Hoz FlórezNo ratings yet
- T2practica2 Equipo1Document12 pagesT2practica2 Equipo1Leonardo Diaz RamirezNo ratings yet
- Informe 10Document8 pagesInforme 10Rany Sanchium TawamNo ratings yet
- Practica 2 y 3Document5 pagesPractica 2 y 3Miguel Angel Marquez CastilloNo ratings yet
- Metodos de ColoracionDocument9 pagesMetodos de Coloracionandres sequedaNo ratings yet
- Practica 02Document9 pagesPractica 02FERNANDA PATRICIA VARGAS PORTUGALNo ratings yet
- Micro 3Document10 pagesMicro 3AlexNo ratings yet
- Laboratorio 2 MicroDocument27 pagesLaboratorio 2 MicroJIMENA TAFURNo ratings yet
- Práctica 3 Tincion de GramDocument7 pagesPráctica 3 Tincion de GramMartin Alonso Torres RamírezNo ratings yet
- Practica 1, Microbiología ELABORACIÓN DE FROTIS EN FRESCO Y TINCIÓN DE GRAMDocument12 pagesPractica 1, Microbiología ELABORACIÓN DE FROTIS EN FRESCO Y TINCIÓN DE GRAMmaria alvarezNo ratings yet
- Informe Tecnicas de ColoracionDocument3 pagesInforme Tecnicas de Coloracionjuan sebastian garzonNo ratings yet
- Laboratorio Técnicas de Tinción y Métodos de SiembraDocument10 pagesLaboratorio Técnicas de Tinción y Métodos de SiembraAna DuranNo ratings yet
- Coloracion de GramDocument12 pagesColoracion de GramLesly Huarcaya CondoriNo ratings yet
- La Coloración de GramDocument11 pagesLa Coloración de Gramdirce823100% (2)
- 1039 Es 1Document2 pages1039 Es 1Ángela GarcíaNo ratings yet
- Agar Eosina y Azul de MetilenoDocument2 pagesAgar Eosina y Azul de MetilenojuanNo ratings yet
- Practiva 06Document3 pagesPractiva 06HANNIA PAOLA GARCIA MARTINEZNo ratings yet
- Identificación Bacterias con Tinciones GramDocument6 pagesIdentificación Bacterias con Tinciones Gramfernanda lemusNo ratings yet
- Tinciones DiferencialesDocument8 pagesTinciones DiferencialesYazNo ratings yet
- Taller N°2Document3 pagesTaller N°2Katt ValenzuelaNo ratings yet
- Lab N°7_ Bacilos Gram-NegativosDocument9 pagesLab N°7_ Bacilos Gram-NegativosWILSON FELIPE DAZA CASTAÑEDANo ratings yet
- Coloracion de Gram 10Document6 pagesColoracion de Gram 10milton clavel magiano shavitNo ratings yet
- Planeamiento Urbano - Trabajo Final - Lima EmprendeDocument53 pagesPlaneamiento Urbano - Trabajo Final - Lima EmprendeElias Antanas Muñoz NeyraNo ratings yet
- La EutanasiaDocument22 pagesLa EutanasiaElias Antanas Muñoz NeyraNo ratings yet
- EnfermedadesautoinmunesyembarazoDocument95 pagesEnfermedadesautoinmunesyembarazoElias Antanas Muñoz NeyraNo ratings yet
- Neonatal Resuscitation 2011Document5 pagesNeonatal Resuscitation 2011Elias Antanas Muñoz NeyraNo ratings yet
- Informe de Susana VillaránDocument14 pagesInforme de Susana VillaránSandra OtoyaNo ratings yet
- Bacterias y VirusDocument11 pagesBacterias y Virusmanuelmadrid07No ratings yet
- Genética y Biología MolecularDocument5 pagesGenética y Biología MolecularChris Recinos VillaNo ratings yet
- Mitosis y Meiosis: División Celular y Formación de GametosDocument6 pagesMitosis y Meiosis: División Celular y Formación de GametosyorgelisNo ratings yet
- PrimersDocument5 pagesPrimersManuel Andres Hernandez HurtadoNo ratings yet
- Catabolismo de Los Aminoacidos II ParcialDocument27 pagesCatabolismo de Los Aminoacidos II ParcialmichelNo ratings yet
- Microorganismos industriales en la elaboración de panDocument7 pagesMicroorganismos industriales en la elaboración de pankatterins castilloNo ratings yet
- La Neurona: Célula Especializada en Recibir, Conducir y Transmitir Señales ElectroquímicasDocument3 pagesLa Neurona: Célula Especializada en Recibir, Conducir y Transmitir Señales ElectroquímicasSaly Vásquez GonzálezNo ratings yet
- Microbiologia IndustrialDocument32 pagesMicrobiologia Industrialmarco williamNo ratings yet
- Cuestionario Corto CRISPRDocument3 pagesCuestionario Corto CRISPRMei Chang Poblete100% (1)
- Medios de Cultivo para Hongos in VitroDocument12 pagesMedios de Cultivo para Hongos in VitroJUAN PABLO VERGARA REYESNo ratings yet
- La Información HereditariaDocument17 pagesLa Información HereditariaErika KelsyNo ratings yet
- Trafico Intracelular de ProteinasDocument27 pagesTrafico Intracelular de ProteinasPhillip David Ormeño Vasquez0% (1)
- Arqueas o ArqueobacteriasDocument2 pagesArqueas o ArqueobacteriasAlexander YepesNo ratings yet
- Azitromicina y otros antibióticos oftálmicosDocument4 pagesAzitromicina y otros antibióticos oftálmicosAdolph GreyNo ratings yet
- Técnicas de SembradoDocument9 pagesTécnicas de SembradoNoe JonatanNo ratings yet
- Biologia Columbus 2Document11 pagesBiologia Columbus 2sandy rondoyNo ratings yet
- Biología Superior Taller de Refurzo Académico 2do ParcialDocument2 pagesBiología Superior Taller de Refurzo Académico 2do ParcialRuth ArriagaNo ratings yet
- Traducción Del ADNDocument25 pagesTraducción Del ADNIsay Ig100% (2)
- Ciclo celular: etapas G1, S, G2, MDocument1 pageCiclo celular: etapas G1, S, G2, MFabian MolinaNo ratings yet
- Ejercicios Capitulo 7Document5 pagesEjercicios Capitulo 7julian0% (1)
- Cap57 - Metabolismo de Los NucleótidosDocument27 pagesCap57 - Metabolismo de Los NucleótidosDANIEL ALEJANDRONo ratings yet
- Indicadores de Calidad Sanitaria de Pollo Crudo Comercializado en MeridaDocument12 pagesIndicadores de Calidad Sanitaria de Pollo Crudo Comercializado en MeridaEvelyn Barrios RojasNo ratings yet
- Los Plastídios Resuelven Los Límites Genéricos de LaDocument31 pagesLos Plastídios Resuelven Los Límites Genéricos de Lagustavo riveraNo ratings yet
- Catalogo ProductosDocument478 pagesCatalogo ProductosAlex Corzo MarticorenaNo ratings yet
- Resultados ElectroforesisDocument2 pagesResultados ElectroforesisRosaQuezadaNo ratings yet
- Clasificación de Las AngiospermasDocument3 pagesClasificación de Las AngiospermasLuis BautistaNo ratings yet
- Microbiologia Medica MED403P11 Mesa 2 POS01 AntibiogramaDocument3 pagesMicrobiologia Medica MED403P11 Mesa 2 POS01 AntibiogramaDavid J. EscobarNo ratings yet
- Unión CelularDocument10 pagesUnión CelularAuRee' DenizNo ratings yet
- Genética Bíblica 04 - Las Dos Simientes PDFDocument7 pagesGenética Bíblica 04 - Las Dos Simientes PDFgilNo ratings yet
- Mitosis y MeiosisDocument5 pagesMitosis y MeiosisDistri MatianNo ratings yet