Professional Documents
Culture Documents
Tabla de Configuración Electrónica
Uploaded by
Renny HernandezOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Tabla de Configuración Electrónica
Uploaded by
Renny HernandezCopyright:
Available Formats
Tabla de configuracin electrnica
Z=1 Z=2 Z=3 Z=4 Z=5 Z=6 Z=7 Z=8 Z=9 Z = 10 Z = 11 Z = 12 Z = 13 Z = 14 Z = 15 Z = 16 Z = 17 Z = 18 Z = 19 Z = 20 Z = 21 Z = 22 Z = 23 Z = 24 Z = 25 Z = 26 Z = 27 Z = 28 Z = 29 Z = 30 Z = 31 Z = 32 Z = 33 Z = 34 Z = 35 Z = 36 Z = 37 Z = 38 Z = 39 Z = 40 Z = 41 Z = 42 Z = 43 Z = 44 Z = 45 Z = 46 Hidrgeno Helio Litio Berilio Boro Carbono Nitrgeno Oxgeno Flor Nen Sodio Magnesio Aluminio Silicio Fsforo Azufre Cloro Argn Potasio Calcio Escandio Titanio Vanadio Cromo Manganeso Hierro Cobalto Nquel Cobre Cinc Galio Germanio Arsnico Selenio Bromo Kriptn Rubidio Estroncio Itrio Circonio Niobio Molibdeno Tecnecio Rutenio Rodio Paladio H: He: Li: 1s 2 1s 2 1 1s 2s
1
Be: 1s22s2 B: 1s22s22p1 C: 1s22s22p2 N: 1s22s22p3 O: 1s22s22p4 F: 1s22s22p5 Ne: 1s22s22p6
Na:
2
1s 2s 2p 3s
2 6 2
Mg: 1s 2s 2p 3s Al: 1s22s22p63s23p1 Si: 1s22s22p63s23p2
P:
2
1s 2s 2p 3s 3p
2 6 2 4
S: 1s 2s 2p 3s 3p Cl: 1s22s22p63s23p5 Ar: 1s22s22p63s23p6 K: 1s22s22p63s23p64s1 Ca: 1s22s22p63s23p64s2 Sc: 1s22s22p63s23p63d14s2 Ti: 1s22s22p63s23p63d24s2 V: 1s22s22p63s23p63d34s2 Cr: 1s22s22p63s23p63d54s1 Mn: 1s22s22p63s23p63d54s2 Fe: 1s22s22p63s23p63d64s2 Co: 1s22s22p63s23p63d74s2 Ni: 1s22s22p63s23p63d84s2 Cu: 1s22s22p63s23p63d104s1 Zn: 1s22s22p63s23p63d104s2
Ga: Ge: 1s 2s 2p 3s 3p 3d 4s 4p 2 2 6 2 6 10 2 2 1s 2s 2p 3s 3p 3d 4s 4p
2 2 6 2 6 10 2 1
As: 1s22s22p63s23p63d104s24p3 Se: 1s22s22p63s23p63d104s24p4 Br: 1s22s22p63s23p63d104s24p5 Kr: 1s22s22p63s23p63d104s24p6 Rb: 1s22s22p63s23p63d104s24p65s1 Sr: 1s22s22p63s23p63d104s24p65s2 Y: 1s22s22p63s23p63d104s24p64d15s2 Zr: 1s22s22p63s23p63d104s24p64d25s2 Nb: 1s22s22p63s23p63d104s24p64d45s1 Mo: 1s22s22p63s23p63d104s24p64d55s1
Tc:
2
1s 2s 2p 3s 3p 3d 4s 4p 4d 5s
2 6 2 6 10 2 6 7
10
Ru: 1s 2s 2p 3s 3p 3d 4s 4p 4d 5s1 Rh: 1s22s22p63s23p63d104s24p64d85s1 Pd: 1s22s22p63s23p63d104s24p64d10
Z = 47 Z = 48 Z = 49 Z = 50 Z = 51 Z = 52 Z = 53 Z = 54 Z = 55 Z = 56 Z = 57 Z = 72 Z = 73 Z = 74 Z = 75 Z = 76 Z = 77 Z = 78 Z = 79 Z = 80 Z = 81 Z = 82 Z = 83 Z = 84 Z = 85 Z = 86 Z = 87 Z = 88 Z = 89
Plata Cadmio Indio Estao Antimonio Telurio Yodo Xenn Cesio Bario Lantano Hafnio Tntalo Volframio Renio Osmio Iridio Platino Oro Mercurio Talio Plomo Bismuto Polonio Astato Radn Francio Radio Actinio
Ag: 1s22s22p63s23p63d104s24p64d105s1 Cd: 1s22s22p63s23p63d104s24p64d105s2 In: 1s22s22p63s23p63d104s24p64d105s25p1 Sn: 1s22s22p63s23p63d104s24p64d105s25p2 Sb: 1s22s22p63s23p63d104s24p64d105s25p3 Te: 1s22s22p63s23p63d104s24p64d105s25p4 I: 1s22s22p63s23p63d104s24p64d105s25p5 Xe: 1s22s22p63s23p63d104s24p64d105s25p6 Cs: [Xe]6s1 Ba: [Xe]6s2
La: [Xe]5d 6s
14 2
1 2
Hf: [Xe]4f 5d 6s2 Ta: [Xe]4f145d36s2 W: [Xe]4f145d46s2 Re: [Xe]4f145d56s2 Os: [Xe]4f145d66s2 Ir: [Xe]4f145d76s2 Pt: [Xe]4f145d96s1 Au: [Xe]4f145d106s1 Hg: [Xe]4f145d106s2 Tl: [Xe]4f145d106s26p1
Pb: [Xe]4f 5d 6s 6p
14 10 2 2
Bi: [Xe]4f145d106s26p3 Po: [Xe]4f145d106s26p4 At: [Xe]4f145d106s26p5 Rn: [Xe]4f145d106s26p6 Fr: [Xe]4f145d106s26p67s1 Ra: [Xe]4f145d106s26p67s2 Ac: [Xe]4f145d106s26p66d17s2
Nmero atmico
De Wikipedia, la enciclopedia libre Saltar a: navegacin, bsqueda En qumica, el nmero atmico es el nmero entero positivo que es igual al nmero total de protones en el ncleo del tomo. Se suele representar con la letra Z (del alemn: Zahl, que quiere decir nmero). El nmero atmico es caracterstico de cada elemento qumico y representa una propiedad fundamental del tomo: su carga nuclear.
Radio atmico
De Wikipedia, la enciclopedia libre Saltar a: navegacin, bsqueda
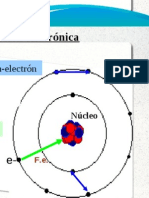
Para otros usos de este trmino, vase Radio. El radio atmico identifica la distancia que existe entre el ncleo y el orbital ms externo de un tomo. Por medio del radio atmico es posible determinar el tamao del tomo. Dependiendo del tipo de elemento, existen diferentes tcnicas para su determinacin como la difraccin de neutrones, de electrones o de rayos X. En cualquier caso no es una propiedad fcil de medir ya que depende, entre otras cosas, de la especie qumica en la que se encuentre el elemento en cuestin. En un grupo cualquiera, el radio atmico aumenta desde arriba hacia abajo debido al aumento en el n de niveles de E. Al ser mayor el nivel de energa, el radio atmico es mayor. En los perodos, el radio atmico disminuye al aumentar el nmero atmico (Z), hacia la derecha, debido a la atraccin que ejerce el ncleo sobre los electrones de los orbitales ms externos, disminuyendo as la distancia ncleo-electrn. El radio atmico puede ser covalente o metlico. La distancia entre ncleos de tomos "vecinos" en unas molculas es la suma de sus radios covalentes, mientras que el radio metlico es la mitad de la distancia entre ncleos de tomos "vecinos" en cristales metlicos. Usualmente, cuando se habla de radio atmico, se refiere a radio covalente.
Electronegatividad
De Wikipedia, la enciclopedia libre Saltar a: navegacin, bsqueda La electronegatividad, (abreviacin EN, smbolo (letra griega chi)) es una propiedad qumica que mide la capacidad de un tomo (o de manera menos frecuente un grupo funcional) para atraer hacia l los electrones, o densidad electrnica, cuando forma un enlace covalente en una molcula.1 Tambin debemos considerar la distribucin de densidad electrnica alrededor de un tomo determinado frente a otros, tanto en una especie molecular como en un compuesto no molecular. La electronegatividad de un tomo determinado est afectada fundamentalmente por dos magnitudes, su masa atmica y la distancia promedio de los electrones de valencia con respecto al ncleo atmico. Esta propiedad se ha podido correlacionar con otras propiedades atmicas y moleculares. Fue Linus Pauling el investigador que propuso esta magnitud por primera vez en el ao 1932, como un desarrollo ms de su teora del enlace de valencia.2 La electronegatividad no se puede medir experimentalmente de manera directa como, por ejemplo, la energa de ionizacin, pero se puede determinar de manera indirecta efectuando clculos a partir de otras propiedades atmicas o moleculares. Se han propuesto distintos mtodos para su determinacin y aunque hay pequeas diferencias entre los resultados obtenidos todos los mtodos muestran la misma tendencia peridica entre los elementos.
El procedimiento de clculo ms comn es el inicialmente propuesto por Pauling. El resultado obtenido mediante este procedimiento es un nmero adimensional que se incluye dentro de la escala de Pauling. Esta escala vara entre 0,7 para el elemento menos electronegativo y 4,0 para el mayor. Es interesante sealar que la electronegatividad no es estrictamente una propiedad atmica, pues se refiere a un tomo dentro de una molcula3 y, por tanto, puede variar ligeramente cuando vara el "entorno"4 de un mismo tomo en distintos enlaces de distintas molculas. La propiedad equivalente de la electronegatividad para un tomo aislado sera la afinidad electrnica o electroafinidad. Dos tomos con electronegatividades muy diferentes forman un enlace inico. Pares de tomos con diferencias pequeas de electronegatividad forman enlaces covalentes polares con la carga negativa en el tomo de mayor electronegatividad.
Qu diferencia existe entre nmero de oxidacin y valencia?
La valencia son los electrones que ese tomo pone en juego en un enlace. Son los electrones que se ganan, pierden o comparten. La valencia a diferencia del nmero de oxidacin, no tiene signo.
El nmero o estado de oxidacin tiene signo porque considera a las uniones como inicas por lo tanto es positivo si el tomo pierde electrones o los comparte con un tomo que tenga tendencia a ganarlos ( ms electronegativo). Es negativo si el tomo gana electrones. La tendencia a ganar o perder depende de cuantos electrones tengan en el ltimo nivel por cuanto los tomos reaccionan para alcanzar la configuracin de un gas noble por ser sta ms estable.
Los metales por lo tanto tienen nmeros de oxidacin positivos porque tienden a ceder electrones. Los no metales por el contrario tienen nmeros de oxidacin negativo porque en una unin inica tienden a ganar electrones.
Ejemplos Fe2O3 Valencia hierro: 3
Valencia oxgeno:2 Nmero oxidacin hierro: +3 porque pierde 3 electrones Nmero oxidacin oxgeno: -2 porque cada oxgeno gana 2 electrones. Nmero de oxidacin o de valencia Es el nmero de electrones que un tomo capta o cede (total o parcialmente) al formar un compuesto. Es negativo si gana electrones y positivo si los pierde Los metales solo tienen nmeros de oxidacin positivos. Los no metales pueden tener nmeros de oxidacin positivos y negativos En general, los nmeros de oxidacin de un elemento dependen del grupo en el que se encuentra. Se pueden establecer reglas nemotcnicas para recordarlos. Por ejemplo, todos los elementos del grupo 1 tienen nmero de oxidacin +1, y todos los del grupo 17, -1; los elementos del grupo 17 que tienen nmeros de oxidacin positivo tienen +1, +3, +5 y +7, que son los nmeros impares hasta la unidad del nmero de grupo. Los elementos del grupo 16 tienen como nmero de oxidacin negativo, -2; los elementos del grupo 16 que tienen nmeros de oxidacin positivo tienen +2, +4 y +6, que son los nmeros pares hasta la unidad del nmero de grupo. En cualquier frmula qumica se escriben en primer lugar los elementos situados a la izquierda del sistema peridico (menos electronegativos), y en segundo lugar los situados a la derecha (ms electronegativos). Esta regla tiene una excepcin con el flor (F) (debido a su alta electronegatividad), ya que cuando se combina con el hidrgeno (H), este se escribe en segundo lugar. La electronegatividad aumenta en un perodo del sistema peridico de izquierda a derecha.
Imagen:
Sistema peridico de los elementos
You might also like
- Configuración Grafica o Spin y Configuracion ElectronicaDocument6 pagesConfiguración Grafica o Spin y Configuracion ElectronicaAlexis Macias Saavedra50% (8)
- Cuestionario Contestado Sobre La Tabla PeriodicaDocument4 pagesCuestionario Contestado Sobre La Tabla Periodicabetybury86% (65)
- Raíces de Los Elementos Químicos de La Tabla PeriódicaDocument1 pageRaíces de Los Elementos Químicos de La Tabla PeriódicaBorne Quantique100% (2)
- ElectronegatividadDocument6 pagesElectronegatividadAbby AvendañoNo ratings yet
- Apuntes QuimicaDocument53 pagesApuntes QuimicaRoman GonzalezNo ratings yet
- Cuestionario N°1 - RetroalimentaciónDocument10 pagesCuestionario N°1 - RetroalimentaciónVanessa ValderramaNo ratings yet
- Las Configuraciones Electrónicas y El Principio de ConstrucciónDocument57 pagesLas Configuraciones Electrónicas y El Principio de ConstrucciónLaura PerdomoNo ratings yet
- Qui123!1!2015 - Clase Hasta Estructura LewisDocument117 pagesQui123!1!2015 - Clase Hasta Estructura LewisAdriana Toro RosalesNo ratings yet
- Átomos y MoléculasDocument20 pagesÁtomos y MoléculasVazquez YazminNo ratings yet
- QuimicaDocument6 pagesQuimicaelizabethNo ratings yet
- Practica 1. Oxidacion de Los Metales.Document9 pagesPractica 1. Oxidacion de Los Metales.DENISE YAEL VIZCAYA ROJASNo ratings yet
- 9 Demuestre Que El Tamaño de Los Átomos Decrece de Izquierda A Derecha Usando El Segundo Periodo de La Tabla PeriódicaDocument4 pages9 Demuestre Que El Tamaño de Los Átomos Decrece de Izquierda A Derecha Usando El Segundo Periodo de La Tabla PeriódicaYessid Páez NúñezNo ratings yet
- 1-Resumen Estructura AtomicaDocument7 pages1-Resumen Estructura AtomicaJahir Landeros100% (1)
- Afinidad ElectrónicaDocument4 pagesAfinidad ElectrónicaGabino Garcia SorianoNo ratings yet
- Enlace iónicoDocument7 pagesEnlace iónicomaritza loyoNo ratings yet
- 05 Sistema Peri DicoDocument7 pages05 Sistema Peri Dicomiruiz12113281100% (1)
- Propiedades Atómicas y Su Variación PeriódicaDocument7 pagesPropiedades Atómicas y Su Variación PeriódicaMauricio MauNo ratings yet
- Configuración electrónica y enlaces químicosDocument46 pagesConfiguración electrónica y enlaces químicoskarinaNo ratings yet
- Spain DataDocument4 pagesSpain DataXurxo FreitasNo ratings yet
- El Enlace QuímicoDocument7 pagesEl Enlace QuímicoBlanca Nury Carmona HiguitaNo ratings yet
- AFINIDAD ELECTRÓNICA Segunda Unidad QuimicaDocument10 pagesAFINIDAD ELECTRÓNICA Segunda Unidad QuimicaAbel Nohpal BrionesNo ratings yet
- Sistema periódico y enlaces químicosDocument19 pagesSistema periódico y enlaces químicosM. Daniel Esquivel MorganNo ratings yet
- ÁTOMODocument33 pagesÁTOMOAlfredo Hernandez OrtizNo ratings yet
- La tabla periódica: Bloques, periódicos y grupos. Ubicación de los elementos. Propiedades periódicas: radio atómico, electronegatividad, energía de ionización, carácter metálico. Propiedades periódicas. Ejercicios y Problemas de aplicación.Document36 pagesLa tabla periódica: Bloques, periódicos y grupos. Ubicación de los elementos. Propiedades periódicas: radio atómico, electronegatividad, energía de ionización, carácter metálico. Propiedades periódicas. Ejercicios y Problemas de aplicación.waldir marcelinoNo ratings yet
- Estructura atómica y modelos atómicosDocument17 pagesEstructura atómica y modelos atómicosRocioRVNo ratings yet
- Química - Propiedades Periódicas de Los Elementos.Document23 pagesQuímica - Propiedades Periódicas de Los Elementos.Noel MatíasNo ratings yet
- Taller 1 - Materiales IndustrialesDocument7 pagesTaller 1 - Materiales IndustrialesKenneth MosqueraNo ratings yet
- El átomo: partículas fundamentales y experimento de RutherfordDocument4 pagesEl átomo: partículas fundamentales y experimento de Rutherfordlopéz uytNo ratings yet
- Clase 3 Tabla Periodica y Nomenclatura InorganicaDocument67 pagesClase 3 Tabla Periodica y Nomenclatura Inorganicacamitorres02No ratings yet
- Presentación UC5Document31 pagesPresentación UC5Alexey LunaNo ratings yet
- Tabla Periodica Propiedades PeriodicasDocument31 pagesTabla Periodica Propiedades PeriodicasCoockita Juarez MendezNo ratings yet
- Introduccion Al Electron y Sus InterDocument50 pagesIntroduccion Al Electron y Sus InterNora Colegz LezzyNo ratings yet
- QUIMICADocument57 pagesQUIMICALauraGarellaNo ratings yet
- Teria de Pilas1Document32 pagesTeria de Pilas1Margareth ZambranoNo ratings yet
- 4 - Propiedades PeriodicasDocument12 pages4 - Propiedades PeriodicasKatherin AiteNo ratings yet
- Componentes del átomo y sus característicasDocument30 pagesComponentes del átomo y sus característicasnicNo ratings yet
- Teoría Atómica y Nomenclatura QuímicaDocument46 pagesTeoría Atómica y Nomenclatura QuímicaDavid Martinez BravoNo ratings yet
- 7) Enlace QuimicoDocument13 pages7) Enlace QuimicoKrysttal RamosNo ratings yet
- Electrón de ValenciaDocument4 pagesElectrón de ValenciaChuchNo ratings yet
- Taller 2 Átomos, Moléculas, Iones, Tabla PeriódicaDocument5 pagesTaller 2 Átomos, Moléculas, Iones, Tabla PeriódicaArleyNo ratings yet
- 3-Perspectiva Tabla PeriodicaDocument3 pages3-Perspectiva Tabla PeriodicaLucas CraiyacichNo ratings yet
- Tepría AtómicaDocument21 pagesTepría AtómicaAngela FerminNo ratings yet
- Expo Cristaloquimica Mhg-2005Document92 pagesExpo Cristaloquimica Mhg-2005Javier LaborínNo ratings yet
- Tarea Individual 4Document5 pagesTarea Individual 4Giovanni RodriguezNo ratings yet
- Formacion de Los EnlacesDocument7 pagesFormacion de Los EnlacesAlexander Lugo LópezNo ratings yet
- Clase 3. Tabla Periódica y EnlacesDocument35 pagesClase 3. Tabla Periódica y EnlacesFelipe Sebastian Angel SoyiooNo ratings yet
- Tabla Períodica 2013 SalaDocument112 pagesTabla Períodica 2013 SalaAndrés De la GranaNo ratings yet
- Examen de Medio Curso ResueltoDocument5 pagesExamen de Medio Curso ResueltoPedro Tolentino OrnetaNo ratings yet
- Tendencia de La Tabla PeriodicaDocument3 pagesTendencia de La Tabla PeriodicaShallelys TapiasNo ratings yet
- Reaccion REDOXDocument10 pagesReaccion REDOXCDAMNUNo ratings yet
- UST Clase 4 Teo. Atom-Conf. ElectDocument41 pagesUST Clase 4 Teo. Atom-Conf. ElectAnnahí UribeNo ratings yet
- Configuraciones ElectrónicasDocument5 pagesConfiguraciones ElectrónicasEster MartínezNo ratings yet
- Química de Los Compuestos OrgánicosDocument7 pagesQuímica de Los Compuestos OrgánicosHola Como estasNo ratings yet
- 3 Estructura Basica Del Atomo y Sus InteraccionesDocument39 pages3 Estructura Basica Del Atomo y Sus InteraccionesJoa DiazNo ratings yet
- Propiedades Compuestos IonicosDocument8 pagesPropiedades Compuestos IonicosIcei ZambranoNo ratings yet
- Unidad 1. Fisica de SemiconductoresDocument20 pagesUnidad 1. Fisica de SemiconductoresFortinoNo ratings yet
- Teoría de Configuración Electrónica y OrbitalesDocument5 pagesTeoría de Configuración Electrónica y OrbitalesFrnzNo ratings yet
- Afinidad Electronica QuimicaDocument4 pagesAfinidad Electronica QuimicaJorge Quintero100% (1)
- BiologiaDocument16 pagesBiologiaMagda PabonNo ratings yet
- Oxidacion de Los MetalesDocument6 pagesOxidacion de Los MetalesclarisitapNo ratings yet
- Motor EsDocument68 pagesMotor EsjuandavidNo ratings yet
- Motor ElectricoDocument17 pagesMotor ElectricoMaria Luisa RodriguezNo ratings yet
- Tema 11 - Motores ElectricosDocument20 pagesTema 11 - Motores Electricosdj_davidNo ratings yet
- CALIBREDocument1 pageCALIBRERenny HernandezNo ratings yet
- Tema 11 - Motores ElectricosDocument20 pagesTema 11 - Motores Electricosdj_davidNo ratings yet
- Rotor Bloquedo y VacioDocument2 pagesRotor Bloquedo y VacioRenny HernandezNo ratings yet
- Motor ElectricoDocument17 pagesMotor ElectricoMaria Luisa RodriguezNo ratings yet
- Tema 11 - Motores ElectricosDocument20 pagesTema 11 - Motores Electricosdj_davidNo ratings yet
- Motor ElectricoDocument17 pagesMotor ElectricoMaria Luisa RodriguezNo ratings yet
- Tema 11 - Motores ElectricosDocument20 pagesTema 11 - Motores Electricosdj_davidNo ratings yet
- Circuito EquivalenteDocument5 pagesCircuito EquivalenteRenny HernandezNo ratings yet
- Ensayo en Vacío y Cortocircuito de Un Transformador TrifásicoDocument3 pagesEnsayo en Vacío y Cortocircuito de Un Transformador TrifásicoRenny HernandezNo ratings yet
- Motores MonofasicosDocument30 pagesMotores MonofasicosRenny HernandezNo ratings yet
- Motores MonofasicosDocument30 pagesMotores MonofasicosRenny HernandezNo ratings yet
- Ensayoenvacio 120916135851 Phpapp02 para EstudiarDocument8 pagesEnsayoenvacio 120916135851 Phpapp02 para EstudiarRenny HernandezNo ratings yet
- 01 Maquinas Asincronas Jaula de Ardilla HMDocument10 pages01 Maquinas Asincronas Jaula de Ardilla HMmarcelobacatubacaNo ratings yet
- Presentacion de Circuitos Trifacicos.Document37 pagesPresentacion de Circuitos Trifacicos.Renny HernandezNo ratings yet
- Rotor Bloquedo y VacioDocument2 pagesRotor Bloquedo y VacioRenny HernandezNo ratings yet
- Criteriodeestabilidadenloss 140621111837 Phpapp01 PDFDocument26 pagesCriteriodeestabilidadenloss 140621111837 Phpapp01 PDFRenny HernandezNo ratings yet
- Ejercicios Capitulo 2 Mallas FDproDocument10 pagesEjercicios Capitulo 2 Mallas FDproJorge AlmadaNo ratings yet
- Acción o ReacciónDocument14 pagesAcción o ReacciónRenny HernandezNo ratings yet
- Erroryestabilidad 140813113000 Phpapp01Document2 pagesErroryestabilidad 140813113000 Phpapp01Renny HernandezNo ratings yet
- Motores eléctricos: problemas resueltos de CC con excitación serie y derivaciónDocument21 pagesMotores eléctricos: problemas resueltos de CC con excitación serie y derivaciónMarco Martinez SantiagoNo ratings yet
- Logica Divina o CientíficaDocument2 pagesLogica Divina o CientíficaRenny HernandezNo ratings yet
- Decreto 1417 Condiciones Generales de ContratacionDocument38 pagesDecreto 1417 Condiciones Generales de ContratacionMiguel Capote Del Rosario BrachoNo ratings yet
- Ejercicios TransformadoresDocument14 pagesEjercicios TransformadoresRenny HernandezNo ratings yet
- Calidad Total RennyDocument11 pagesCalidad Total RennyRenny HernandezNo ratings yet
- El Mantenimiento Como Fuente de RentabilidadDocument19 pagesEl Mantenimiento Como Fuente de RentabilidadpablosolizNo ratings yet
- Ejercicios Resueltos Del Tema 4 PDFDocument20 pagesEjercicios Resueltos Del Tema 4 PDFCOMMOMOLONo ratings yet
- Ejercicios Resueltos Del Tema 4 PDFDocument20 pagesEjercicios Resueltos Del Tema 4 PDFCOMMOMOLONo ratings yet
- Desengrasante ND 150Document5 pagesDesengrasante ND 150EverhtTticaFlowers50% (2)
- Informe 3 Lab QMC 200 de La Destilacion FraccionadaDocument6 pagesInforme 3 Lab QMC 200 de La Destilacion FraccionadaAlecita MendozaNo ratings yet
- Balanza CuantiDocument9 pagesBalanza CuantiCocarico Quispe Jhoseline RosyNo ratings yet
- Reporte de Quimica (Unidad II)Document21 pagesReporte de Quimica (Unidad II)Jeff2003xDNo ratings yet
- Seminario de fisiología humana: Neurotransmisores y neuropéptidosDocument35 pagesSeminario de fisiología humana: Neurotransmisores y neuropéptidosBeatriz VillarrealNo ratings yet
- Cristaloquimica Mine.3Document65 pagesCristaloquimica Mine.3MiguelAngelTacuriHuamanNo ratings yet
- Analisis Edificio CastelarDocument54 pagesAnalisis Edificio CastelarLuz Vargas100% (2)
- Modelo Cta SesionDocument5 pagesModelo Cta SesionCarlos Castillo100% (2)
- IDENTIFICACION DE FUNCIONES INORGANICAS InformeDocument18 pagesIDENTIFICACION DE FUNCIONES INORGANICAS InformeSandra Milena Forigua CastiblancoNo ratings yet
- Uso de Microorganismos en La AgriculturaDocument14 pagesUso de Microorganismos en La AgriculturaGuillermoNo ratings yet
- Haga Una Tabla Indicando Los Índices de Saponificación de Los Diversos Aceites y GrasasDocument2 pagesHaga Una Tabla Indicando Los Índices de Saponificación de Los Diversos Aceites y Grasasmilagros UNSANo ratings yet
- Agentes Del MetamorfismoDocument2 pagesAgentes Del MetamorfismoEngel Espinoza100% (1)
- Realizaciones Con Hormigon Auto Compact AnteDocument16 pagesRealizaciones Con Hormigon Auto Compact AnteIrving CasadosNo ratings yet
- Termodinámica - Asignación 1 - A2023Document2 pagesTermodinámica - Asignación 1 - A2023Luis MezaNo ratings yet
- Taller HidraulicaDocument2 pagesTaller Hidraulicajefc89No ratings yet
- Sofamel Tarifa Septiembre 2015Document184 pagesSofamel Tarifa Septiembre 2015VEMATELNo ratings yet
- Exposición Rutas MetabolicasDocument15 pagesExposición Rutas MetabolicasAlessandro UitzNo ratings yet
- Yacimiento Tipo IOCGDocument24 pagesYacimiento Tipo IOCGMaribel Gatita PererozaNo ratings yet
- Gestion 3Document9 pagesGestion 3Camilo Aponte BNo ratings yet
- Aparejo de ProduccionDocument22 pagesAparejo de Producciongerar36100% (2)
- Los Frutos Del Bosque o Pequeños Frutos en La Cornisa Cantábrica - El ArándanoDocument406 pagesLos Frutos Del Bosque o Pequeños Frutos en La Cornisa Cantábrica - El ArándanoAndrésNo ratings yet
- Acido BaseDocument19 pagesAcido BasepanteraonccaNo ratings yet
- Guía Métodos de Separación de MezclasDocument5 pagesGuía Métodos de Separación de MezclasMassiel Vergara100% (2)
- Vino TintoDocument12 pagesVino TintoNicol Muñoz FuentealbaNo ratings yet
- Documento Sistemas PladurDocument16 pagesDocumento Sistemas PladurfbuendiaNo ratings yet
- Fundamentos de la fijación tisularDocument54 pagesFundamentos de la fijación tisularMarq DiegoNo ratings yet
- Crioprotectores JonathanDocument5 pagesCrioprotectores JonathanJonathan BcNo ratings yet
- Proceso MCAWDocument38 pagesProceso MCAWJE JosephNo ratings yet
- Flotabilidad y EstabilidadDocument5 pagesFlotabilidad y EstabilidadMagui CMNo ratings yet
- Preparación y valoración de NaOH y H2SO4Document5 pagesPreparación y valoración de NaOH y H2SO4Jocelyn LópezNo ratings yet
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaFrom EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaRating: 5 out of 5 stars5/5 (1866)
- El lenguaje del cuerpo: Una guía para conocer los sentimientos y las emociones de quienes nos rodeanFrom EverandEl lenguaje del cuerpo: Una guía para conocer los sentimientos y las emociones de quienes nos rodeanRating: 4 out of 5 stars4/5 (49)
- No desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaFrom EverandNo desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaRating: 4.5 out of 5 stars4.5/5 (11)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaFrom EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaRating: 5 out of 5 stars5/5 (200)
- Resetea tu mente. Descubre de lo que eres capazFrom EverandResetea tu mente. Descubre de lo que eres capazRating: 5 out of 5 stars5/5 (196)
- Tu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaFrom EverandTu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaRating: 5 out of 5 stars5/5 (2)
- Terapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSFrom EverandTerapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSRating: 5 out of 5 stars5/5 (1)
- Disciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)From EverandDisciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)Rating: 5 out of 5 stars5/5 (10)
- El poder del optimismo: Herramientas para vivir de forma más positivaFrom EverandEl poder del optimismo: Herramientas para vivir de forma más positivaRating: 4.5 out of 5 stars4.5/5 (15)
- Psiconeuroinmunología para la práctica clínicaFrom EverandPsiconeuroinmunología para la práctica clínicaRating: 5 out of 5 stars5/5 (4)
- Psicogenealogía: Sanar las heridas del alma y encontrarse a uno mismoFrom EverandPsicogenealogía: Sanar las heridas del alma y encontrarse a uno mismoRating: 5 out of 5 stars5/5 (5)
- Influencia. La psicología de la persuasiónFrom EverandInfluencia. La psicología de la persuasiónRating: 4.5 out of 5 stars4.5/5 (14)
- Pensamiento Crítico: Utiliza modelos mentales para desarrollar tomas de decisiones efectivas y habilidades de resolución de problemas. Supera los obstáculos cognitivos y las falacias en los sistemas para pensar con claridad en tu vida cotidiana.From EverandPensamiento Crítico: Utiliza modelos mentales para desarrollar tomas de decisiones efectivas y habilidades de resolución de problemas. Supera los obstáculos cognitivos y las falacias en los sistemas para pensar con claridad en tu vida cotidiana.Rating: 4.5 out of 5 stars4.5/5 (33)
- ¿Por qué mis padres no me aman?: Empezando a sanarFrom Everand¿Por qué mis padres no me aman?: Empezando a sanarRating: 4.5 out of 5 stars4.5/5 (33)
- Maneja tus emociones: Curso intensivo de mindfulness y regulación emocionalFrom EverandManeja tus emociones: Curso intensivo de mindfulness y regulación emocionalRating: 4.5 out of 5 stars4.5/5 (140)
- Después de la infidelidad: Sanando el dolor y restableciendo la conFrom EverandDespués de la infidelidad: Sanando el dolor y restableciendo la conRating: 4 out of 5 stars4/5 (15)
- Cómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.From EverandCómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.Rating: 5 out of 5 stars5/5 (54)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceFrom EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceRating: 5 out of 5 stars5/5 (8)
- Ansiedad infantil. Los trastornos explicados a los padresFrom EverandAnsiedad infantil. Los trastornos explicados a los padresRating: 4.5 out of 5 stars4.5/5 (25)
- Contra la ansiedad: Una guía completa para manejar emociones difícilesFrom EverandContra la ansiedad: Una guía completa para manejar emociones difícilesRating: 5 out of 5 stars5/5 (58)
- Resumen de El Sutil Arte de que te Importe un Carajo, de Mark MansonFrom EverandResumen de El Sutil Arte de que te Importe un Carajo, de Mark MansonRating: 4.5 out of 5 stars4.5/5 (15)
- Te odio - no me abandones: Comprender el trastorno límite de personalidadFrom EverandTe odio - no me abandones: Comprender el trastorno límite de personalidadRating: 5 out of 5 stars5/5 (3)
- Libro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRAFrom EverandLibro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRARating: 4 out of 5 stars4/5 (26)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoFrom EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoRating: 5 out of 5 stars5/5 (2)