Professional Documents
Culture Documents
Biologia
Uploaded by
Michał DulibanOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Biologia
Uploaded by
Michał DulibanCopyright:
Available Formats
do witamin.
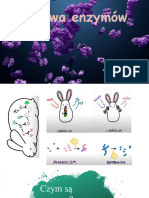
Koenzymy ulegaj zuyciu podczas zachodzcych z ich udziaem reakcji Budowa enzymw:Enzymy zbudowane s zawsze z czci biakowej enzymatycznych, dlatego do organizmu dostarczane musz by prekursory zwanej apoenzymem. Niektre, posiadaj dodatkowo cz niebiakow koenzymw, czsto w postaci witamin. zwan koenzymem lub grup prostetyczn. W ten sposb zbudowane s enzymy zoone. Cae poczenie nazywa si holoenzymem. Rnica midzy koenzymem a grup prostetyczna polega na sile wizania tej czci enzymu z apoenzymem. Jeeli cz niebiakowa zwizana jest w sposb trway, niedysocjujcy, to nosi nazw grupy prostetycznej. Gdy cz niebiakowa poczona jest w sposb luny, ale wizaniem, ktre dysocjuje to mwi si o koenzymie. CECHY ENZYMW: - obniaj energi aktywacji tzn. energia potrzebna do przebiegu reakcji jest mniejsza ni ta, ktra byaby potrzebna do jej zajcia bez enzymu, -nie zuywaj si podczas reakcji (mog dziaa wielokrotnie), -s specyficzne dla danego typu reakcji - czsteczka substratu pasuje do centrum aktywnego jak klucz do zamka, -jeden enzym katalizuje jeden typ reakcji lub jedn reakcj, -nie wpywaj na rwnowag reakcji. Przebieg reakcji enzymatycznej:Enzym czy si z substratem tworzc przejciowo kompleks enzym - substrat. Kompleks ten rozpada si na produkt i enzym katalizujcy reakcj z nastpn czsteczk substratu. Enzymy podzielono na 6 gwnych klas biorc pod uwag typ katalizowanej reakcji:1.oksydoreduktazy- katalizuj reakcj utleniania i redukcji 2.transferazykatalizuj przenoszenie grup funkcyjnych lub atomw z jednego zwizku na drugi 3.hydrolazy - katalizuj rozpad wiza z udziaem czsteczek wody - reakcja hydrolizy 4.liazy- katalizuj rozpad wiza bez udziau wody 5.izomerazy katalizuj reakcje przegrupowa wewntrzczsteczkowych 6.ligazy (syntetazy) katalizuj syntez nowych wiza kowalencyjnych przy udziale wiza makroergicznych ATP Dziaanie enzymw:Niezwyk cech enzymw jest ich zdolno do katalizowania przebiegu reakcji chemicznych w organizmach ywych. Dziki temu reakcje te przebiegaj szybko i selektywnie w rodowisku panujcym w komrkach organizmu. Kady enzym - a poznanych jest ich ju tysice - katalizuje reakcje z tylko jednym substratem, s to tzw. enzymy monospecyficzne oraz takie, ktre wchodz w reakcje z wieloma substratami. Miejscem odpowiedzialnym za rozpoznanie substratu a nastpnie przyczenia i przeprowadzenie reakcji jest tzw. centrum aktywne. Znajduje si ono w zagbieniu powierzchni makroczsteczki. Oprcz centrum aktywnego moe istnie w apoenzymie centrum allosteryczne. Jest to miejsce do ktrego przyczaj si efektory, czyli drobnoczsteczkowe zwizki wpywajce na aktywno enzymu. Enzymy, ktrych aktywno moe by regulowana w taki sposb nazywa si enzymami allosterycznymi.Centrum aktywne jest to przestrzenny ukad kilku reszt aminokwasowych, charakterystycznych dla danego enzymu. Struktura przestrzenna substratu musi by odpowiednio dopasowana do struktury centrum aktywnego enzymu. Takie dopasowanie strukturalne substratu i enzymu mona porwna do zalenoci jaka zachodzi miedzy kluczem a zamkiem ( model Fishera) lub midzy doni a rkawiczk (model Koshlanda).Cz enzymw dla swojej aktywnoci wymaga obecnoci grupy niebiakowej. Enzymy, ktrych aktywno wynika z samego tylko apoenzymu mogaby dziaa w komrce dopiero po syntezie co miaoby dla komrki niekorzystne dziaanie. W zwizku z tym s one syntetyzowane jako formy nieaktywne tzw. proenzymy czyli enzymogeny. Takie nieaktywne formy ulgaj aktywacji dopiero po wydzieleniu do miejsca dziaania danego enzymu, np. nieaktywne formy enzymw katalizuj hydroliz biaek takich jak:pepsynogen, trypsynogen.Przy omawianiu enzymw naley wspomnie o izoenzymach - enzymach katalizujcych t sama reakcj ale rnicych si odmienna struktur . Izoenzymy wystpuj u tego samego osobnika w rnych narzdach, np. dehydrogenaza kwasu mlekowego wystpuje w postaci piciu izoenzymw rozdzielonych pomidzy wtrob, minieszkieletowe i miesie sercowy.
Czynniki wpywajce na szybko reakcji enzymatycznych: 1.temperatura - wzrost temperatury powoduje wzrost szybkoci reakcji enzymatycznych (regua van't Hoffa). W temperaturze powyej 37 - 400C dochodzi do spadku reakcji zwizanej z denaturacj termiczn biaka enzymatycznego. Optimum okoo 380C jest typowe dla wikszoci enzymw, cho s enzymy dziaajce w temperaturze 70 800C s to np. bakterie yjce w gorcych rdach. 2.pH rodowiska - jest rne dla rnych enzymw np. kwane dla pepsyny, obojtne dla amylazy linowej, zasadowe dla trypsyny 3.stenie substratu - szybko reakcji enzymatycznej zaley od stenia substratu, tak wic stenie enzymu jest stae a zmienia si tylko stenie substratu, pozostae czynniki s optymalne dla danego enzymu. Szybko reakcji ronie wraz ze wzrostem stenia substratu, osigajc przy pewnym steniu substratu maksymalny poziom. Dalszy wzrost stenia substratu nie moe powodowa zwikszenia szybkoci reakcji, poniewa wszystkie dostpne centra aktywne enzymu zostay wysycone substratem. 4.inhibitory - na szybko reakcji enzymatycznej wpywaj zwizki okrelane jako inhibitory, ktre hamuj aktywno enzymw. Hamowanie czyli inaczej inhibicja moe by procesem nieodwracalnym lub odwracalnym. Przy hamowaniu nieodwracalnym inhibitor czy si z enzymem tworzc kompleks enzym - inhibitor, przez co enzym traci swoj aktywno. Hamowanie odwracalne polega na tym, e inhibitor o strukturze przestrzennej zblionej do struktury substratu wie si w centrum aktywnym enzymu uniemoliwiajc wizanie substratu lub inhibitor wpywa na centrum aktywne w ten sposb e substrat jest wizany ale dalsza reakcja zostaje zahamowana. Reakcje katalizowane przez enzymy prawie zawsze przebiegaj przy temperaturze niszej od 100 oC, cinieniu atmosferycznym i pH obojtnym. Miejsce aktywne enzymu - jest regionem enzymu, ktry wie substrat i przemienia go w produkt. Jest to rodzaj trjwymiarowej przestrzeni w obrbie enzymu (zagbienia) w ktrym tworzy si rodowisko niepolarne co uatwia wizanie z substratem. Wystpuj tam liczne sabe oddziaywania chemiczne, m.in. elektrostatyczne, hydrofobowe, Van der Wallsa, wodorowe oraz odwracalnie kowalencyjne. Cykl katalityczny - szereg przemian chemicznych majcych na celu zmian substratu w produkt przy udziale enzymu. Mona to przedstawi w nastpujcym rwnaniu: substrat + enzym ---> kompleks substrat-enzym ---> produkt + enzym Modele obrazujce wizanie substratu przez enzym: 1.model zamka i klucza (wg Fisher, z roku 1894) - zakada, e kadorazowo w reakcji chemicznej dany enzym "pasuje" do substratu niczym zamek do klucza i moliwe jest poczeni tylko odpowiedniego enzymu z jemu przynalenym substratem. Ich ksztaty s sztywne i pasuj jedynie po odpowiednim dopasowaniu. 2.model indukowanego dopasowania (wg Koshland, z roku 1958) - zwizanie substratu zachodzi na skutek indukowanej zmiany konformacji miejsca aktywnego. Inaczej mwic oddziaywanie substratu wymusza na enzymie tak zmian konformacyjn miejsca aktywnego, e substrat czy si z enzymem komplementarnie. Specyficzno substratowa - specyficzno enzymu wzgldem substratu, decyduj o niej waciwoci i uoenie przestrzenne reszt aminokwasowych tworzcych miejsce aktywne (co determinuje rodzaj przyczanej czsteczki).
Reakcje enzymatyczne:Na powierzchni czsteczki enzymu znajduje si zagbienie bdce miejscem wizaniasubstratu, nazwane centrum aktywnym. Przestrzenne dopasowanie substratu do centrum aktywnego enzymu umoliwia ich zwizanie i wytworzenie kompleksu enzym - substrat (E-S), a w efekcie obnienie energii aktywacji reakcji, ktrej nastpnie ulegnie substrat (energia aktywacji to taka ilo energii, ktra jest niezbdna do zapocztkowania reakcji chemicznej). Oglne rwnanie reakcji enzymatycznej katalizowanej przez enzym mona zapisa w nastpujcy sposb:ENZYM + SUBSTRAT KOMPLEKS E-S ENZYM + PRODUKT. W ustaleniu odpowiedniej konformacji centrum aktywnego umoliwiajcej utworzenie kompleksu E-S czsto bior udzia aktywatory, ktrych role peni jony metali lub koenzymy.Enzymy s specyficzne wzgldem substratw, co oznacza, e jeden rodzaj enzymu katalizuje tylko jeden rodzaj reakcji (pasuj do siebie jak klucz do zamka). Kada czsteczka biokatalizatora moe by jednak wykorzystywana wielokrotnie, przetwarzajc kolejno wiele czsteczek substratu (nie zuywa si w czasie pojedynczej przemiany).Istotne jest to, e enzymy nie przesuwaj stanu rwnowagi katalizowanej reakcji, a jedynie skracaj czas potrzebny na jego osignicie.Wykres zalenoci szybkoci reakcji enzymatycznej od stenia substratu nosi nazwkrzywej Michaelisa. W zakresie niskich ste substratu szybko reakcji ronie liniowo ze wzrostem stenia substratu, za przy steniach przekraczajcych pewn warto, szybko ta osiga warto maksymaln i nie ulega zmianie. Mona wyznaczy takie stenie substratu, przy ktrym szybko katalizowanej reakcji osiga poow szybkoci maksymalnej - stenie to nazwane zostao sta Michaelisa. Przy steniu substratu rwnym staej Michaelisa enzym wysycony jest w poowie (poowa enzymu wystpuje w postaci kompleksu ES).Oprcz staej Michaelisa wyznaczany jest take inny parametr - liczba obrotw. Jest to liczba czsteczek substratu, ktre ulegy przemianie w produkt w jednostce czasu (w warunkach penego wysycenia enzymu). Liczba obrotw wiadczy o aktywnoci enzymu.Na aktywno enzymw wpywaj rne czynniki, wrd nich wymieni mona temperatur i pH. Wraz ze wzrostem temperatury ronie szybko reakcji enzymatycznych. Jednak po przekroczeniu pewnej wartoci szybko ta nagle spada, co jest wynikiem cieplnej denaturacji enzymu. Optymalna temperatura to taka, przy ktrej szybko katalizowanej reakcji jest najwiksza. Nie mona wyznaczy takiej reguy w przypadku wpywu pH na aktywno enzymatyczn, poniewa enzymy wykazuj du rnorodno w zalenoci od rodowiska, w jakim dziaaj. Przykadem mog byenzymy trawienne, spord ktrych amylaza linowa wykazuje optimum w rodowisku obojtnym, pepsyna w kwanym, a trypsyna w zasadowym Regulacja aktywnoci enzymw:hamowanie kompetycyjne (wspzawodnicze)okrela sytuacj, w ktrej dwa rodzaje czsteczek - substrat i inhibitor wspzawodnicz o jedno centrum aktywne; znoszone jest przez zwikszenie stenia substratu (powoduje wypieranie inhibitora); ten typ inhibicji wykorzystywany jest w przypadku leczenia ludzi zatrutych metanolem - w charakterze inhibitora kompetycyjnego podaje si wwczas etanol;hamowanie niekompetycyjne (niewspzawodnicze)-a zatem takie, w ktrym centrum aktywne enzymu blokowane jest czciowo przez substancj niepodobn do substratu; pomimo tego substrat moe by wizany, ale reakcja ulega zahamowaniu; przykadem inhibiotorw niekompetycyjnych s jony metali cikich (miedzi, rtci).regulacja allosteryczna-polega na odwracalnej zmianie kinetyki reakcji enzymatycznej pod wpywem zwizku (ligandu), ktry moe przycza si do enzymu w miejscu innym ni substrat, nazwanymcentrum allosterycznym; ligand taki powoduje zmiany konformacyjne enzymu podlegajcego regulacji, ktra moe polega na inhibicji lub indukcji (aktywno enzymu wzrasta po przyczeniu ligandu do centrum allosterycznego).Koenzym to uczestniczca w reakcji enzymatycznej niebiakowa cz enzymu nietrwale zwizana z czci biakow (apoenzymem). Bierze udzia w przenoszeniu elektronw, protonw lub grup atomw w trakcie katalizowanej reakcji. Wrd koenzymw wymieni mona: ATP (adenozynotrifosforan),NAD ,NADP. Wiele z nich wykazuje pokrewiestwo
You might also like
- Regulacja Aktywnosci EnzymowDocument22 pagesRegulacja Aktywnosci EnzymowgawendapolaNo ratings yet
- Skrypt EnzymyDocument24 pagesSkrypt EnzymyKasia PurtakNo ratings yet
- Enzymy NotatkaDocument4 pagesEnzymy NotatkaZuzia BlubNo ratings yet
- ENZYMYDocument5 pagesENZYMYNatalia BoguszNo ratings yet
- Enzymy - Notatki by Matura100procentDocument8 pagesEnzymy - Notatki by Matura100procentWeronika NowakowskaNo ratings yet
- Regulacja Aktywnosci Enzymow PDFDocument18 pagesRegulacja Aktywnosci Enzymow PDFGab MarNo ratings yet
- Regulacja Aktywności EnzymówDocument5 pagesRegulacja Aktywności EnzymówmarNo ratings yet
- MetabolizmDocument27 pagesMetabolizmEmilia PawlikNo ratings yet
- Tekst Biologia EnzymyDocument1 pageTekst Biologia Enzymy262hnvgy6zNo ratings yet
- ENZYMYDocument7 pagesENZYMYВладислав КурилоNo ratings yet
- Regulacja Aktywności EnzymówDocument2 pagesRegulacja Aktywności Enzymównininka221No ratings yet
- MetabolizmDocument5 pagesMetabolizmMaja KapuścińskaNo ratings yet
- Budowa Dzialanie I Funkcje EnzymowDocument15 pagesBudowa Dzialanie I Funkcje EnzymowMałgorzata SokółNo ratings yet
- enzymyDocument4 pagesenzymyjprucnal352No ratings yet
- Metabolizm I EnzymyDocument9 pagesMetabolizm I EnzymyOla KowalskaNo ratings yet
- ENZYMY NoweDocument33 pagesENZYMY Noweiza matejczykNo ratings yet
- Budowa Dzialanie I Funkcje EnzymDocument14 pagesBudowa Dzialanie I Funkcje EnzymmnkNo ratings yet
- Biologia 4Document4 pagesBiologia 4Dominika WięsykNo ratings yet
- EnzymyDocument4 pagesEnzymyzuziaNo ratings yet
- Regulacja Aktywności EnzymówDocument7 pagesRegulacja Aktywności Enzymówywt09765No ratings yet
- Anabolizm To Procesy SyntezyDocument3 pagesAnabolizm To Procesy SyntezykaktuszNo ratings yet
- Ważne PDFDocument38 pagesWażne PDFAnonymous 7vjENho3kNo ratings yet
- Genetyka OperonyDocument8 pagesGenetyka OperonyMagdalena RożekNo ratings yet
- Zrzut Ekranu 2023-09-13 o 07.57.07Document45 pagesZrzut Ekranu 2023-09-13 o 07.57.07fortniteszymon9No ratings yet
- Referat BiologiaDocument2 pagesReferat BiologiaSpaikuś Cs:goNo ratings yet
- Budowa I Działanie Enzymów - ZadaniaDocument1 pageBudowa I Działanie Enzymów - ZadaniaMikołajNo ratings yet
- Ekspresja Genów GenomDocument110 pagesEkspresja Genów GenomankahpfankaNo ratings yet
- Enzymy DrobnoustrojówDocument33 pagesEnzymy DrobnoustrojówlusyticNo ratings yet
- Podstawowe Zasady Metabolizmu PDFDocument19 pagesPodstawowe Zasady Metabolizmu PDFmnkNo ratings yet
- Podstawowe Zasady MetabolizmuDocument16 pagesPodstawowe Zasady MetabolizmuAleksandra ChrzanowskaNo ratings yet
- Biochemia-notatki-z-wykładówDocument20 pagesBiochemia-notatki-z-wykładów84rksqpch8No ratings yet
- Czynniki Warunkujące Aktywność Enzymów Na Przykładzie Fosfatazy Kwaśnej - 03 - 2011 - PDFDocument9 pagesCzynniki Warunkujące Aktywność Enzymów Na Przykładzie Fosfatazy Kwaśnej - 03 - 2011 - PDFolkasalwaNo ratings yet
- Enzymy I BiałkaDocument29 pagesEnzymy I BiałkaMonika KbNo ratings yet
- METABOLIZM cz.1 (Tematy Od 1 Do 5)Document16 pagesMETABOLIZM cz.1 (Tematy Od 1 Do 5)Katarzyna StrugałaNo ratings yet
- Enzmy Biologia NotatkaDocument10 pagesEnzmy Biologia NotatkajfdkggggggNo ratings yet
- Biochemia 1Document11 pagesBiochemia 1Agnieszka ŁukomskaNo ratings yet
- MetabolizmDocument2 pagesMetabolizmMikołaj MitkaNo ratings yet
- Dokument Bez Tytułu - 2023-03-09T220736.617Document1 pageDokument Bez Tytułu - 2023-03-09T220736.617Błażej jaroszukNo ratings yet
- Toksykologia - Wykład 3 - Mechanizmy DziałaniaDocument8 pagesToksykologia - Wykład 3 - Mechanizmy Działaniamahoutsukai_monikaNo ratings yet
- BiochemiaDocument10 pagesBiochemiaharvartchNo ratings yet
- Biologia Na Czasie 2 ZR 6-7Document2 pagesBiologia Na Czasie 2 ZR 6-7Kinga KurpasNo ratings yet
- MetabolizmDocument4 pagesMetabolizmNina WąsikNo ratings yet
- Podstawy MetabolizmuDocument50 pagesPodstawy Metabolizmusara.cute2100No ratings yet
- Neurotransmisja MózguDocument13 pagesNeurotransmisja MózguWiktoria KutyłowskaNo ratings yet
- biofiz14Document3 pagesbiofiz14czesiochomikujNo ratings yet
- BiochemiaDocument1 pageBiochemiaEmilia VakNo ratings yet
- 1.kierunki Przemian MetabolicznychDocument3 pages1.kierunki Przemian MetabolicznychVanillaNo ratings yet
- Immuno Kartkã Wki - Pytania I OdpowiedziDocument30 pagesImmuno Kartkã Wki - Pytania I OdpowiedziOliwia ChruścielNo ratings yet
- 2.Test-Budowa I Działanie EnzymówDocument6 pages2.Test-Budowa I Działanie EnzymówLeon KubiakNo ratings yet
- 4.1 Podstawowe Zasady MetabolizmuDocument5 pages4.1 Podstawowe Zasady MetabolizmuDominik BudniakNo ratings yet
- FIZJOTHORNDocument227 pagesFIZJOTHORNhania.marciniukNo ratings yet
- Egzamin Fizjologia RoślinDocument3 pagesEgzamin Fizjologia RoślinRoman KuliberdaNo ratings yet
- proteomikaDocument11 pagesproteomikajanstefan309No ratings yet
- Fizjologia Ogólna Z Neurofizjologią - Wykład 1Document5 pagesFizjologia Ogólna Z Neurofizjologią - Wykład 1karolinakulacz2No ratings yet
- Fizjo 2Document8 pagesFizjo 2Anumia chanNo ratings yet
- 2018biologia Klucz PDFDocument13 pages2018biologia Klucz PDFToto1No ratings yet
- O Czym Mowi Teoria Zderzen AktywDocument23 pagesO Czym Mowi Teoria Zderzen AktywmajaNo ratings yet
- L - 12 Błony Wewnątrzkomórkowe - Siateczka Śródplazmatyczna, Aparat Golgiego, LizosomyDocument5 pagesL - 12 Błony Wewnątrzkomórkowe - Siateczka Śródplazmatyczna, Aparat Golgiego, LizosomyJulia GajdowskaNo ratings yet